Гипофункция яичников представляет собой совокупность патологических изменений женского организма,
в результате которых развиваются нарушения менструального цикла и функционирования репродуктивной системы в целом.
Яичниковая недостаточность редко встречается изолированно. Указанная патология отмечается нечасто и поражает порядка 0.1% женщин фертильного возраста и около 1% представительниц слабого пола после 40 лет.
Значительно чаще гипофункция наблюдается у больных с вторичной аменореей. Несмотря на то, что патология не несет непосредственной опасности для пациентки, она вызывает целый комплекс психосоматических и вегетативных проявлений, существенно снижающих уровень жизни.
Что называют гипофункцией яичников
Гипофункция яичников – это патологическое снижение функциональной активности женских половых желез. Такое состояние приводит к нарушениям овариально-менструального цикла и связанным с ними расстройствам, что и становится поводом для обращения к врачу и проведения обследования.
Не стоит путать это состояние с физиологическим угасанием репродуктивной функции в преклимактерическом периоде. Умеренная гипофункция яичников у женщин после 40 лет (по сравнению с их активностью в 25-30-летнем возрасте) – нормальное явление. Оно связано с естественным истощением овариального запаса и физиологическим уменьшением активности гипоталамо-гипофизарно-яичниковой системы. Если это не сопровождается ранним прекращением менструаций и появлением других жалоб, беспокоиться не стоит. Врачами в этом случае будет диагностировано лишь наступление преклимактерического периода, что при его нормальном течении не требует проведения какого-либо лечения.
Гипофункция яичников бывает первичной и вторичной. Это подразделение основано на уровне первичного поражения. Если причиной возникновения синдрома является поражение собственно яичниковой ткани, говорят о первичной гипофункции. А при нарушениях на любом более высоком уровне нейроэндокринной регуляции работы гонад – о вторичном характере расстройства.
Профилактика недостаточности яичников
Профилактические мероприятия имеют смысл только, если речь идет о вторичной яичниковой недостаточности. Важно соблюдать несколько простых рекомендаций:
- Стоит своевременно лечить все инфекционные патологии и заболевания репродуктивной системы.
- Нельзя переохлаждаться.
- Важно рационально питаться и соблюдать режим сна и бодрствования.
- Следует отказаться от курения и злоупотребления алкоголем.
- При первых же подозрениях на «неполадки» в работе половой системы — нужно незамедлительно обращаться к врачу.
Гипофункция придатков матки существенно сказывается не только на репродуктивном здоровье, но и на здоровье в целом. При первых же признаках развития болезни рекомендуется немедленно обращаться к врачу.
Причины и формы первичной гипофункции
Первичная гипофункция яичников включает:
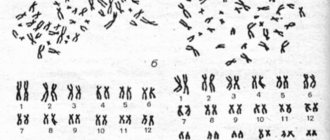
- Структурные изменения гонад, обусловленные нарушениями на этапе их закладки или внутриутробного этапа развития. Причиной этого могут быть перенесенные матерью в первом триместре беременности инфекционные заболевания и экзогенные интоксикации. Возможна и генетически обусловленная патология, в таких случаях говорят о дизгенезии гонад. Наиболее распространенными хромосомными аномалиями при этом являются мозаицизм и синдром тестикулярной феминизации с формированием женского фенотипа при наличии мужского кариотипа и мужских половых желез.
- Синдром истощенных яичников, называемый также преждевременным климаксом. Патогенетически проявляется слишком быстрым «расходом» заложенного внутриутробно овариального резерва, что и становится причиной аномально раннего перехода женщины в менопаузу.
- Синдром резистентных яичников.
- Постнатальное поражение половых желез, сопровождающееся значительным уменьшением их размера или развитием массивного склерозирования (рубцевания). Сюда же относят последствия операций на придатках, в том числе состояние после резекции или удаления яичника.
Нередко все формы постнатального поражения включают в синдром истощенных яичников, рассматривая их в качестве этиологических форм этого заболевания. Да и пренатальную возникшую дисгенезию тоже в целом можно считать состоянием, способствующему развитию раннего климакса. Тем не менее, патогенетически это, все же, разные формы первичной яичниковой гипофункции. Поэтому целесообразно их разделять.
Вторичная гипофункция: какой она бывает и почему возникает
Вторичная гипофункция яичников – это снижение их активности в результате любых эндокринных расстройств у женщины при сохранности гонад. При этом значение могут иметь любые факторы, которые негативно влияют на работу гипоталамо-гипофизарной системы. Ведь именно она оказывает гормон-опосредованное воздействие на «включение» гонад в пубертате и их последующую работу в течение репродуктивного периода.
Основными формами вторичной яичниковой гипофункции считаются:
- Изолированная гипогонадотропная дисфункция, приводящая к развитию гипогонадотропного гипогонадизма. Эта патология может иметь врожденный характер (в том числе наследственно обусловленный) или развиваться уже после полового созревания.
- Функциональные расстройства в гипоталамо-гипофизарно-яичниковой системе, не связанные со структурными повреждениями любого звена. Они могут быть обусловлены стрессом, невротическими нарушениями, гиперпролактинемией, повышенным уровнем тестостерона любого происхождения. Часто в качестве причины вторичной яичниковой гипофункции выступает нефизиологическое снижение массы тела – вследствие экстремальных диет, нервной анорексии, тяжелых соматических заболеваний и интоксикаций.
- Органические поражения гипоталамо-гипофизарной системы. К возможным причинам такой патологии относят разнообразные интракраниальные опухоли, перенесенные менингоэнцефалиты, нейроинфекции и черепно-мозговые травмы, последствия облучения, ряда отравлений, ишемические изменения гипоталамической области.
Чаще всего диагностируются функциональные формы вторичной гипофункции яичников. Большинство из них является потенциально обратимыми при условии адекватной коррекции первичного патологического состояния, вызвавшего дисбаланс в работе гипоталамо-гипофизарно-яичниковой системы.
Причины появления
Естественно, гипофункция яичников не появляется сама по себе. Она провоцируется определенными причинами. Патология бывает первичной или вторичной. В первом случае, она является врожденной, спровоцированной нарушением внутриутробного развития вследствие перенесения инфекционных или воспалительных заболеваний матерью. Что касается вторичной гипофункции, то нарушение возникает под воздействием таких факторов:
- психоэмоциональных расстройств;
- серьезных инфекций;
- резкого снижения уровня эстрогена, а также нарушения функциональности эндокринной системы;
- проблем с метаболизмом;
- генетической предрасположенности;
- инфекционных или воспалительных патологий репродуктивной системы (сальпингоофорит);
- синдрома хронической усталости или истощения организма;
- химиотерапевтического лечения;
- структурных изменений в тканях придатков;
- неправильного питания, соблюдения чрезмерно строгих диет, резкого похудания;
- неконтролируемого применения гормональных противозачаточных средств;
- заболеваний гипоталамо-гипофизарной зоны вследствие психической или механической травмы.
Также развиться нарушение может и вследствие хронического аднексита. Причины гипофункции яичников необходимо выяснить обязательно, иначе лечение патологического состояния будет бесполезным.
Клиническая картина
Симптоматика овариальной недостаточности может появиться у женщины в любом возрасте в течение репродуктивного периода. А при некоторых формах – уже при вступлении девочки в пубертат, при этом у нее фактически не будет происходить «дозревание» половой системы и ее переход в функционально активную стадию.
Основные симптомы гипофункции яичников:
- Нарушения менструального цикла. Они могут включать олигоменорею, первичную или вторичную аменорею. Выраженность нарушений зависит от степени эндокринного дисбаланса и гормонального дефицита. При врожденных формах отмечается задержка наступления менархе и пубертата.
- Патология беременности, если зачатие у женщины, все же, наступило естественным путем или с использованием вспомогательных репродуктивных технологий. У женщины при отсутствии медикаментозной коррекции яичниковой гипофункции отмечается высокий риск самопроизвольного аборта на ранних сроках и невынашивания. Поэтому у них нередко в первом триместре диагностируется угроза прерывания беременности с частичной отслойкой нормально имплантировавшегося плодного яйца.
- Ановуляция и связанные с этим репродуктивные расстройства в виде бесплодия. В зависимости от формы и возраста появления овариальной недостаточности проблемы с естественным зачатием могут носить первичный или вторичный характер. При этом чаще всего диагностируется эндокринный тип бесплодия.
- Субатрофия слизистой оболочки влагалища и вульвы, снижение толщины функционального слоя эндометрия. При длительно существующей и выраженной овариальной недостаточности отмечается также инволюция изначально нормально развитых внутренних половых органов. Если же имеющиеся нарушения приводят к отсутствию адекватной эндокринной стимуляции яичников в пубертатном периоде, диагностируется половой инфантилизм. При этом отмечается гипоплазия (недоразвитие) матки, стенок влагалища, придатков, наружных половых органов со слабой выраженностью вторичных половых признаков.
- Возникающие из-за выраженного дефицита эстрогенов психовегетативные расстройства, аналогичные симптоматике климактерия. Не являются обязательным признаком, свойственны в основном синдрому истощенных яичников. При остальных формах овариальной гипофункции таких ярких характерных вегетативных проявлений обычно не бывает.
Гипоэстрогения при овариальной недостаточности может также способствовать развитию остеопороза со склонностью к атравматическим переломам, патологическому набору веса, ухудшению состояния кожи и волос, затяжным или рецидивирующим аффективным расстройствам депрессивного спектра, атерогенному дисбалансу липидов в крови.
Конечно, такие состояния обычно не являются доминирующими в клинической картине. Нередко их появление не связывают с имеющейся у женщины гипофункцией яичников. И проводимое в таких случаях симптоматическое лечение не даст ожидаемого эффекта без коррекции основной патологии.
Самые распространенные патологии
К сожалению, почти все заболевания яичников, не вылеченных вовремя или не поддающихся лечению, грозят бесплодием. Особенно опасны бессимптомные заболевания, когда женщину ничто не беспокоит. Поэтому женщинам рекомендуется посещать гинеколога не менее 1 раза в год.
Часто встречаются патологии яичников у женщин независимо от ее возраста.
Воспаление
Развивается при попадании и развитии инфекции в яичники, часто сопровождается развитием воспаления маточных труб и связок. Инфекцию могут вызвать вирусы, микробы и простейшие организмы.
Воспалительный процесс в яичниках сопровождается рядом симптомов:
- Боль внизу живота слева или справа.
- Повышение температуры тела до 38-39 градусов.
- Недомогание, головная боль, тошнота.
- Выделения из влагалища с неприятным запахом, их желтоватый цвет говорит о наличии гноя.
Воспаления яичников хорошо поддается лечению, после анализов и осмотра врач назначает антибиотики определенной группы (пенициллины, цефалоспорины и другие), и через некоторое время болезнь отступает. Во время лечения (в среднем до месяца) рекомендуется воздержание от половой близости.
Рак яичника
Самое непредсказуемое заболевание, так как почти не имеет симптомов на ранней стадии. Рак яичников может пускать метастазы в другие близлежащие органы, поэтому заболевание опасно и непредсказуемо. Лечение назначает врач-онколог после УЗИ, томографии, анализов для подтверждения диагноза.
Далее проводится операция по удалению опухоли или органа. Чаще всего, при несвоевременном обнаружении рака яичника удаляются все органы репродуктивной системы женщины.
Киста
Заболевание сильно распространенно, имеет много различных видов, чаще всего удаляется хирургическим путем или тщательно наблюдается врачом, пока не наступит ухудшение.
Заболевание часто протекает бессимптомно, выявляется при УЗИ. Из осложнений заболевания опасны перекручивание ножки кисты и разрыв ее стенки. Они уже сопровождаются сильнейшими болями внизу живота, высокой температурой и тошнотой.
При них требуется незамедлительная помощь (операция). Кисты способны в большинстве случаев исчезнуть самостоятельно, а некоторые могут перерождаться в злокачественные образования.
Доброкачественные опухоли
Могут развиваться в любой части яичника, характеризуются болевыми приступами в нижней части живота (тупая боль), либо совсем не беспокоят. При обнаружении назначается операция для удаления опухоли.
Диагностика
Диагностика синдрома овариальной недостаточности должна быть направлена не только на подтверждение факта снижения функциональной активности яичников. Важнейшей задачей проводимого обследования является уточнение уровня поражения, что позволит отдифференцировать первичные и вторичные формы этой патологии. По возможности проводят и поиск причины имеющихся расстройств. Также необходимо выявить степень вторичных изменений в органах-мишенях, развивающихся на фоне гипоэстрогении.
В обследование должно входить:
- Общесоматический и гинекологический осмотр. Это позволит оценить выраженность вторичных половых признаков и состояние слизистой оболочки вульвовагинальной области, ориентировочно определить размеры матки, выявить у пациентки симптомы маскулинизации.
- Оценка базового эндокринного профиля. Для этого определяют уровень ЛГ, ФСГ, прогестерона, эстрогена, пролактина. При сохранении менструальной функции анализ на каждый гормон проводят в соответствующую фазу цикла. При аменорее – несколько раз в течение определенного времени для динамической оценки колебаний.
- Проведение фармакологический проб, помогающих определить уровень нарушений (яичниковый или гипоталамо-гипофизарный) и чувствительность овариальной ткани к гормонам. Используются тесты с введением эстрогена, прогестерона, кломифена, хорионического гонадотропина.
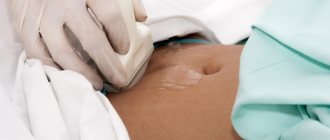
- УЗИ органов малого таза для определения размеров внутренних половых органов, толщины функционального слоя эндометрия, состояния и структуры яичников.
- Рентгенография черепа с прицельным осмотром области турецкого седла, что актуально при вторичном характере гипофункции яичников.
- МРТ гипофиза (также при выявленных гипоталамо-гипофизарных нарушениях, если рентгенография не дала достаточно информации).
Полноценное обследование – основа для грамотного составления схемы последующего лечения и оценки возможности восстановления фертильности.
Механизм регуляции функции яичника в норме и при гипоталамо-гипофизарной дисфункции.
Симптом бесплодия есть проявление истощения компенсаторных возможностей тех или иных звеньев системы регуляции репродукции. В 50 — 70% случае бесплодие определяется состоянием жены, в 20 — 25% случаев — состоянием мужа. В 10 — 30% случаев встречаются смешанные формы, а в 2 — 5% случаев причина бесплодия не ясна (2). В структуре женского бесплодия эндокринные нарушения встречаются в 35 — 40% случаев, нарушения функции маточных труб — в 30 — 40% случаев, маточные факторы — в 10%, шеечные — в 7 — 10% случаев, влагалищные — в 6%, экстрагенитальные — в 1%, психические — в 1% случаев. Такие или сходные данные приводятся в большинстве руководств по гинекологии (10).
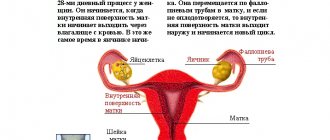
Основой репродуктивной системы женщины является ось гипоталамус — гипофиз — яичник, правильное функционирование которой обеспечивает созревание полноценной яйцеклетки, адекватную подготовку эндометрия к беременности, трубный транспорт гамет, оплодотворение, имплантацию и сохранение ранней беременности.
Высшим органом регуляции гипоталамо-гипофизарно-яичниковой оси является центральная нервная система, путем целого комплекса прямых и обратных связей обеспечивающая стабильность работы системы репродукции при изменении внутренней и внешней среды (14, 21). К настоящему времени открыто более 36 пептидов, регулирующих секрецию Гн-РГ (28). На основании того, что все основные нейроэндокринные круги прямо или косвенно связаны с иммунной системой и кроме эндокринных центров связывают участки мозга с лимфоидной тканью, в настоящее время некоторые исследователи говорят не о нейроэндокринной, а о нейро-иммунно-эндокринной системе регуляции репродукции (30, 33).
Рилизинг-фактором двух главных гонадотропинов, ЛГ и ФСГ, является Гн-РГ, декапептид, синтезированный Schally и Guillemin в 1977 году. Гн-РГ синтезируется в аркуатном ядре медиобазального гипоталамуса и поступает в систему воротного кровотока гипофиза в импульсном режиме. Для обеспечения нормальной секреции гонадотропинов достаточно поддержания стабильной частоты выброса физиологических количеств Гн-РГ. Изменение частоты выброса Гн-РГ меняет не только количество ЛГ и ФСГ, выделяемых гипофизом, но и их соотношение, в то время как даже десятикратное повышение концентрации Гн-РГ ведет только к небольшому снижению выделения ФСГ и никак не меняет секреции ЛГ.
Частота выброса Гн-РГ у человека составляет 1 выброс в 70 — 90 минут и соответствует целому ряду биоритмов (чередованию фаз сна, колебанию скорости клубочковой фильтрации и желудочной секреции, частоте приливов во время климакса и т.д., что подтверждает гипотезу Kleitmann о существовании общего ритма с периодичностью около 90 минут, имеющего связь с базальным циклом покоя — активности (20), который объясняется геофизическими причинами (22, 37). Основными факторами, регулирующими частоту выделения Гн-РГ являются опиаты и альфа-адреноблокаторы (6, 12, 13). Пульсовой генератор ритма — аркуатное ядро — не нуждается для поддержания своей нормальной работы ни в каких влияниях со стороны других отделов нервной системы (1). В физиологических условиях пульсовой генератор получает информацию о выделении гонадотропинов гипофизом по системе короткой обратной связи, так как специальные сфинктеры регулируют градиенты давлений в воротной системе кровотока, и часть крови из гипофиза поступает не в кавернозный синус, а обратно в гипоталамус, что обеспечивает очень высокую местную концентрацию гормонов гипофиза в гипоталамусе (31). Синтез и секреция ЛГ и ФСГ в гипофизе осуществляются одними и теми же клетками (7). На поверхности гонадотропов имеются рецепторы к Гн-РГ, плотность которых зависит от уровня стероидных гормонов в крови и от концентрации Гн-РГ. Соединение Гн-РГ с рецептором вызывает массивное поступление ионов кальция внутрь клетки, что через несколько минут ведет к выбросу запаса ЛГ и ФСГ в кровоток. Кроме того, Гн-РГ вызывает стимуляцию синтеза ЛГ и ФСГ и поддерживает целостность гонадотропов (40). Изменения частоты пульсового генератора меняет соотношение ЛГ и ФСГ, выделяемых гипофизом (24). Так, повышение ритма ведет к значительному повышению выброса ФСГ и к снижению выброса ЛГ. Частотная модуляция информации обеспечивает быстроту и надежность регуляции репродуктивной системы и ее устойчивость к помехам (4, 36). В лютеиновую фазу прогестерон через эндогенные опиаты урежает частоту пульсового генератора, причем данное действие определяется не концентрацией прогестерона, а длительностью его воздействия. Эстрадиол, действуя на гипоталамус и на гонадотропы (увеличение плотности рецепторов Гн-РГ), повышает амплитуду волны ЛГ /ФСГ (16, 39).
Прогестерон стимулирует образование в гипоталамусе ингибитора, устраняющего данное влияние эстрадиола (29, 35). Таким образом исключается возможность пика ЛГ в лютеиновую фазу, что могло бы нарушить созревание когорты фолликулов для следующего менструального цикла (11).
Гонадотропины являются главными регуляторами синтеза и секреции половых стероидов. Местом выработки половых стероидов в организме могут быть фолликулярный комплекс (тека интерна, тека экстерна, гранулеза и ооцит), желтое тело и строма яичника. Полноценность циклических изменений, обеспечивающих подготовку организма женщины к беременности, определяется качеством селекции и созревания доминантного фолликула. Основные закономерности фолликулогенеза были установлены рабочей группой профессора Ходжена на рубеже 1970-х и 1980-х годов (11). Ими были предложены термины рекрутирование, когорта, селекция, установление доминантности. Рекрутированием назван процесс перехода фолликулов из примордиальной стадии в антральную, так как только с этого времени процесс созревания становится зависимым от действия гонадотропинов. Процесс рекрутирования определяется внутрияичниковыми факторами и происходит постоянно, но образовать когорту — группу фолликулов, из которой выделится доминантный — смогут только те фолликулы, которые рекрутируются в последние 4 дня лютеиновой фазы предыдущего цикла (39). Число рекрутируемых фолликулов определяется скорее всего уровнем гонадотропинов в позднюю лютеиновую фазу и локальной концентрацией прогестерона в яичнике, что объясняет чередование овуляции в правом и в левом яичниках. Рост когорты фолликулов в раннюю фолликулярную фазу объясняется благоприятными условиями соотношения ЛГ и ФСГ и локальных концентраций эстрогенов и андрогенов. Действие ЛГ и ФСГ на фолликул строго специализировано: ЛГ стимулирует процесс синтеза андрогенов de novo клетками теки и практически не действует на клетки гранулезы, а ФСГ активирует ароматазную систему гранулезы, превращающую синтезированные в теке андрогены в эстрадиол (15).
Эстрогены и ФСГ тормозят атрезию преантрального фолликула и стимулируют пролиферацию клеток гранулезы, синтез рецепторов к ФСГ и индукцию рецепторов к ЛГ, начинающуюся на периферии фолликула и идущую к центру. Появление рецепторов к ЛГ в клетках гранулезы больших фолликулов является предпосылкой для синтеза прогестерона желтым телом. ЛГ через стимуляцию андрогенного синтеза ограничивает и уменьшает синтез рецепторов к ФСГ, ЛГ, эстрадиолу в клетках фолликула. Синергизм действия ЛГ и ФСГ в раннюю фолликулярную фазу вызывает значительное усиление секреции эстрогенов яичником. Это в свою очередь индуцирует повышение индекса ЛГ/ФСГ, что смещает синтез половых стероидов в фолликулах в сторону преимущественного образования андрогенов. При нормальном развитии событий к 8 дню менструального цикла заканчивается селекция доминантного фолликула, главным свойством которого является способность усиливать эстрогенную продукцию в условиях дефицита ФСГ и полностью подавлять развитие других фолликулов когорты с помощью внутрияичниковых и гипоталамо-гипофизарных связей (8, 11, 18, 42). Если по какой-либо причине доминантный фолликул гибнет, должен вновь произойти рекрутский набор, так как ни один другой фолликул данной когорты не сможет принять на себя роль доминантного. Важную роль в процессе подавления других фолликулов играет полипептидный регулятор ингибин, избирательно подавляющий секрецию ФСГ, и фолликул-регулирующий протеин, избирательно подавляющий ароматазную активность гранулезы.
На 12 — 14 день цикла доминантный фолликул отвечает почти за всю продукцию эстрадиола в больших количествах, что вызывает пик ЛГ и ФСГ, являющийся причиной овуляции.
Важное значение для нормальной работы желтого тела имеет пик ФСГ в середине цикла, обеспечивающий индукцию синтеза рецепторов к ЛГ в клетках гранулезы преовуляторного фолликула.
У здоровых женщин правильное развитие доминантного фолликула вызывает:
- адекватную продукцию эстрадиола, обеспечивающую созревание эндометрия и накопление в его эпителии рецепторов к прогестерону и созревание шеечной слизи;
- полноценную овуляцию;
- подготовку рецепторов к ЛГ в гранулезе, долженствующей превратиться в желтое тело.
Таким образом, качество лютеиновой фазы определяется прежде всего процессами, происходящими в первую фазу цикла. По классификации ВОЗ 1976 года все нарушения эндокринной функции яичников делятся на 7 больших групп:
- гипогонадотропная нормопролактинемическая недостаточность;
- нормогонадотропная нормопролактинемическая недостаточность;
- гипергонадотропная недостаточность;
- анатомическая форма аменореи;
- гиперпролактинемии;
- гиперпролактинемии;
- объемные процессы в гипоталамо-гипофизарной области, не меняющие секрецию пролактина (5).
Подавляющее большинство больных с нарушением функции яичников, обращающихся по поводу бесплодия, относятся ко 2-й группе нарушений по классификации ВОЗ — эугонадотропной гипоталамо-гипофизарной дисфункции. Клинически в данной группе можно выделить подгруппу 2а — больные со спонтанными менструальными циклами — и подгруппу 2б — больные с аменореей. Для больных подгруппы 2а характерны недостаточность лютеиновой фазы вследствие нарушения созревания доминантного фолликула, нарушения овуляции и нарушения функции желтого тела, а также ановуляторные менструальные циклы, отличающиеся тем, что доминантный фолликул созревает, но не овулирует, в период атрезии доминантного фолликула происходит лютеинизация гранулезы и теки, сопровождающиеся резко сниженной продукцией прогестерона. Базальная температура при этом или не повышается, или повышается незначительно.
Недостаточность лютеиновой фазы, ановуляция и аменорея как правило являются выражением степени эндокринных нарушений и часто выступают как стадии одной процесса (34).
Типичным выражением яичниковой недостаточности 2-го типа является повышение отношения ЛГ/ФСГ, сопровождается небольшой (в сравнении с гормон-продуцирующими опухолями) надпочечниковой и /или яичниковой гиперсекрецией андрогенов (5). Традиционно такие формы гипоталамо-гипофизарно-яичниковой дисфункции относили к синдрому поликистозных яичников. Однако данный термин оспаривается рядом авторов. С одной стороны, увеличение яичников может иметь место при синдроме Кушинга, андрено-генитальном синдроме, при гормон-продуцирующих опухолях, а иногда — у здоровых подростков. С другой стороны, у женщин с типичными проявлениями данного синдрома могут быть яичники нормальных размеров. Кроме того, при данном синдроме анатомические изменения яичников являются только следствием нарушенных гормональных взаимодействий в организме.
Поэтому предлагается называть данный вид патологии синдромом гиперандрогении с хронической ановуляцией (19). Со стороны гормональных изменений самыми характерными признаками являются значение отношения ЛГ/ФСГ больше 2 и повышение уровня андрогенов (тестостерона, андростендиона и ДГЭА-С) в периферической крови (17).
По сравнению со здоровыми женщинами, у которых главным эстрогеном в циркулирующей крови является эстрадиол, у женщин с синдромом гиперандрогении значительно повышен уровень эстрона, который может превышать концентрацию эстрадиола. Главным источником повышения уровня эстрона у таких больных является периферическая ароматизация андростендиона. Постоянная и монотонная продукция эстрона сенсибилизирует гипофиз к действию Гн-РГ, следствием чего является повышение отношения ЛГ/ФСГ, секретируемых гипофизом. В свою очередь, высокий уровень ЛГ ведет к чрезмерной стимуляции стромы яичника и теки, результатом чего является чрезмерная продукция андрогенов. В этих условиях резко нарушаются как процесс селекции доминантного фолликула, так и его полноценность, что ведет к опсоменорее, ановуляции, недостаточности лютеиновой фазы и к аменорее (9, 27).
Гипоталамо-гипофизарная дисфункция при II типе яичниковой недостаточности является чисто функциональным нарушением, при котором нарушается положительная обратная связь. Этиология синдрома гиперандрогении с хронической ановуляцией до сих пор не известна. Доказано, что важную роль в развитии синдрома играют наследственность, центральные нарушения катехоламинов, психический стресс и ожирение (32).
Важную роль в развитии заболевания придают дисфункции коры надпочечников. У значительной части больных надпочечники очень чувствительны к стимуляции АКТГ. В связи с этим высказана гипотеза о секреции гипофизом специфического гормона, стимулирующего андрогены коры надпочечников с молекулярным весом около 60 000 (32). Часть больных является гетерозиготными носительницами дефекта С-21-гидроксилазы (38).
Кроме того, повышенную продукцию андрогенов клетками теки может вызвать и повышенный уровень инсулина за счет перекрытия специфичности инсулина и локальных факторов роста (3). Следовательно, гирсутизм и гиперандрогения могут быть проявлением глубоких метаболических расстройств.
Для гиперандрогенной недостаточности яичников характерно повышение амплитуды и частоты залпов ЛГ гипофиза (41).
Важную роль в патогенезе играет влияние андрогенов на уровень белка, связывающего тестостерон и эстрогены (ТЭСГ). При гиперандрогении и ожирении синтез ТЭСГ в печени снижается, что ведет к повышению активных концентраций эстрогенов и тестостерона в крови, в результате чего проявления гиперандрогении усиливаются. Есть указания на то, что важную роль в развитии синдрома играют ненаследственные внутриутробные влияния, и что гиперандрогения у матери может оказывать неблагоприятное влияние на созревание различных ферментных систем плода (25). При синдроме гиперандрогении меняется соотношение норадреналина и допамина, и возникающий дефицит допамина ведет к усилению выброса ЛГ.
Нарушение развития доминантного фолликула и овуляции при нормогонадотропной недостаточности яичников ведет к развитию НЛФ (23).
Выделяют 5 причин развития НЛФ: нарушение созревания фолликула; недостаточная стимуляция ЛГ во 2- фазу цикла; недостаточная и /или запоздалая лютеинизация преовуляторного фолликула; мягкие формы гиперпролактинемии; гиперандрогении различного происхождения (23). Гормональным проявлением НЛФ является снижение продукции прогестерона желтым телом, сопровождающееся нормальной или повышенной секрецией эстрадиола (относительная гиперэстрогения). На клеточном уровне НЛФ проявляется усилением клеточных делений (эндрометрий, молочная железа, миометрий). Клинически НЛФ проявляется предменструальным синдромом, нарушениями менструального цикла, снижением фертильности, доброкачественными опухолями молочных желез и миомой матки. Причинами бесплодия при НЛФ являются недостаточная зрелость эндометрия, затрудняющая нормальную имплантацию и недостаточный для поддержки ранней беременности уровень прогестерона (26).
- The arcuate nucleus and the control of gonadotropin and prolactin secretion in the female rhesus monkey (Macaca mulatta). -Plant T.M., Krey L.S., Moossy J., McCormack J.T., Hess D.L., Knobil E. //Endocrinology, 1978, v. 102, N 1, p. 52-62.
- Baltzer J., Mickan H. Kern Gynäkologie. 4. Aufl. Stuttgart: Thieme, 1985. -685 S.
- Barbieri R.L., Ryan K.J. Hyperandrogenism, insulin resistance and acanthosis nigrans syndrome: A common endocrinopathy with distinct pathophysiologic features. //American Journal of Obstetrics and Gynecology, 1983, v. 147, N 1, p. 90-101.
- Bohumil R.J. Pulsatile variations in hormone levels. //Biorythms and human reproduction. — Ferin M., Halberg F.,Richart R. M., Van de Wiele R. L. (Eds) New York: Wiley, 1974, p. 107-131.
- Breckwoldt M. Störungen der Ovarialfunktion. //Reproduktionsmedizin. -Bettendorf J., Breckwoldt M. (Hrsg.). Stuttgart; New York: Fisher, 1989, S. 258-266.
- Central electrophysiological correlates of pulsatile luteinizing hormone secretion in the rhesus monkey. -Wilson R. S., Kesner J.S., Kaufman J.M,, Uemura T., Akema T., Knobil E. //Neuroendocrinology, 1984, v. 39, N 3, p. 256-260.
- Childs G.V. Functional ultrastructure of gonadotropes: a review. //Morfology of hypothalamus and its connections. -Ganten D., Pfaff D. (Eds.). Berlin: Springer, 1986, p. 49-98.
- Correlation of human follicular fluid inhibin activity with spontaneous an
- Davis O.K., Ravnikar V. Induction of ovulation with Clomiphen Citrate. //Reproductive endocrine therapeutics. – Barbiery L., Schiff I. (Eds.). New York: A.R. Liss, Inc., 1988, p. 1-24.
- Diedrich K., Wildt L. Neue Wege in der Behandlung ovarieller Funktionsstorungen. Teil 1. //Neue Wege in der Diagnostik und Therapie der Weiblichen Sterilität. -Diedrich K., Hrsg. -Stuttgart: F. Enke, 1987, p. 26-40.
- DiZerega G.G., Hodgen G.D. Folliculogenesis in the primate ovarian cycle. //Endocrine review 1981, v. 2, N 1, p. 27-49.
- The effect of morphine on the electrophysiological activity of the hypothalamic luteinizing hormone-releasing hormone pulse generator in the rhesus monkey. -Kesner J.S., Kaufman G., Wilson R. C., Kuroda G., Knobil E. //Neuroendocrinology, 1986, v. 43, N 6, p. 486-488.
- Electrophisiological manifestation of luteinizing hormone releasing hormone pulse generator activity in the rhesus monkey: influence of a adrenergic and dopaminergic blocking agents. -Kaufman J.M., Kesner J.S., Wilson R.S., Knobil E. //Endocrinology, 1985, v. 116, N 4, p. 1327-1333.
- Everett J.W. Central neural control of reproductive functions of the adenohypophysis. //Physiology review, 1964, v. 44, p. 373-431.
- Falck B. Site of production of estrogens in rat ovary as studied by microtransplants. //Acta physiologica Scandinavica, 1959, v. 163, N 1, p. 1.
- Ferin M., van Vugt D., Wardlaw S. The hypothalamic control of the menstrual cycle and the role of endogenous opioid peptides. //Recent progress in hormone research, 1984, v. 40, p. 441-485.
- Givens J.R., Andersen R.N., Umstot E.S. Clinical findings and hormonal responses in patients with polycystic ovarian disease with normal versus elevated LH levels. //Obstetrics and gynecology, 1976, v. 47, N 4, p. 388-394.
- Hoffmann F. Untersuchunden über die hormonale Regulation der Follikelreifung im Zyklus der Frau. //Geburtshilfe und Frauerheilkunde, 1961, Bd. 21, S. 554-560.
- Infertility, contraception and reproductive endocrinology. Ed. by D.R. Mishell, Jr.; V. Davaian, 2-nd edition. — Oradell: Medical Economics Books, 1986. -IX, 688 p.
- Kleitmann N. Sleep and wakefulness. — Chicago: Chicago University Press, 1963. -250 p.
- Lakoski J.M. Cellular electrophysiologycal approaches to the central regulation of female reproductive aging. //Neural control of reproductive function. -J.M. Lakoski, J.R. Perez-Polo, D.K.Rassin (Eds.). -New York: Liss, 1989, p. 209-220.
- Lavie P., Kripke D.F. Ultradian circa 1½ hour rhythms: A multioscillatory system. //Life sciences, 1981, v. 29, N 24, p. 2445-2450.
- Lobo R.A. Polycystic ovary syndrome. //Infertility, contraception and reproductive endocrinology. Ed. by D.R. Mishell, Jr. and V. Davajan, 2-nd edition. — Oradell: Medical Economics Books, 1986, p. 319-336.
- Leyendecker G., Wildt L., Plotz E.J. Die hypothamische Ovarialinsuffizienz.//Gynäkologe, 1981, Bd. 14, N 2, S. 84-103.
- Lobo R.A. Polycystic ovary syndrome. //Infertility, contraception and reproductive endocrinology. Ed. by D.R. Mishell, Jr. and V. Davajan, 2-nd edition. — Oradell: Medical Economics Books, 1986, p. 319-336.
- Mauvais-Jarvis P., Kutten F. Insuffisance gonadotrope dissociée (anovulation et dysovulation)
- The microinvironment of the human antral follicle: Interrelationships among the steroid levels in human antral fluid, the population of granulosa cells and the status of the oocyte in vivo and in vitro. -McNatty K.P., Smith D.M., Makris A., Osathanonolh R., Ryan K.J. //Journal of clinical endocrinology and metabolism, 1979, v. 49, N 6, p. 851-860.
- Miller B.T. Peptide modulation of luteinizing hormone releasing hormone secretion. //Neural control of reproductive function. -J.M. Lakoski, J.R. Perez-Polo, D.K. Rassin (Eds.). New York: A.R.Liss, Inc., 1989, p. 255-271.
- Mode of action of progesterone in the blocade of gonadotropin surges in the rhesus monkey. -Pohl C.R., Richardson W.D., Marshall G., Knobil E. //Endocrinology, 1982, v. 110, N 4, p. 1454-1455.
- The Neuro-immune-endocrine connection. — Cotman C., Brinton R.E., Galaburda A., McEwen B.C. -New York: Raven Press, 1986. -150 p.
- Page R.B. Pituitary blood flow. //American journal of physiology, 1982, v. 243, N 6, p. 427-442.
- Parker L.N., Odell W.B. Control of adrenal androgen secretion. //Endocrine review, 1980, v. 1, N 4, p. 392-410.
- Perez-Polo J.R. Introduction: Neuroimmune modulation of reproductive function. //Neural control of reproductive function. -J.M. Lakoski, J.R. Perez-Polo, D.K. Rassin (Eds.). -New York: A.R. Liss, 1989, p. 307-309.
- Plotz E.J. Differentialdiagnose und Therapie ovarieller Funktionsstörungen: Richtlinien fur die Praxis. //Gynäkologe, 1981, Bd. 14, N 2, S. 145-148.
- The pulsatile pattern of gonadotropin secretion and follicular development durung the menstrual cycle and in women with hypothalamic and hyperandrogenic amenorrhea. -Wildt L., Schwilden H., Werner G., Roll C., Brensing K.A., Vuckhaus J., Böhr M., Leyendecker G. //Brain and pituitary peptides II. — G. Leyendecker, H. Stock, L. Wildt (Eds.). -Basel: Karger, 1983, p. 28-36
- Rushton W.A.H. Peripheral coding in the nervous system. //Sensory communication. -W.A. Rosenblith (Ed.). -New York: Wiley, 1961, p. 20-30.
- Shapiro S. Compass on the 90-minutes sleep-dream cycle. //Sleep and dreaming. -Hartman E. (Ed.) -Boston: Little and Brown, 1970, p. 40-49.
- An update of congenital adrenal hyperplasia. — New M.I., Dupont B., Pang S., Pollack M., Levine S.L. // Recent progress in hormone research, 1981, v. 37, p. 105-181.
- Wildt L. Die endokrine Kontrolle der Ovarialfunktion und die Pathologie endokriner Ovarialfunktionsstörungen. // Neue Wege in Diagnostik und Therapie der weiblichen Sterilität. -Hrsg. von K. Diedrich. — Stuttgart: Enke, 1987, S. 1-25.
- Wildt L. Hypothalamus. //Reproduktionsmedizin. — Hrsg. von Bettendorf G., Breckwoldt M. — Stuttgart: Fischer, 1989, S. 6-22.
- Yen S.S.C. The polycystic ovary syndrome. //Clinical endocrinology, 1980, v. 12, N 2, p. 177-207.
- Zeleznik A.J., Schuler H.M., Reichert L.C., Jr. Gonadotropin binding sites in the rhesus monkey ovary: Role of the vasculature in the selective distribution of human chorionic gonadotropin to the preovulatory follicle. //Endocrinology, 1981, v. 109, N 2, p. 356-362.
d induced follicular maturation. -Murrs R.P., Lobo J.D., Campeau J.D., Nakamura R.M., Brown J., Ujita E.L., DiZerega G.S. //Journal of Clinical Endocrinology and Metabolism, 1987, v. 64, N 1, p. 148-152.
. //Médecine de la reproduction. Gynécologie endocrinienne. -Paris: Flammarion, 1982, p. 305-319.
.
Теги: менструальный цикл
Фертильность при овариальной недостаточности
Яичники – важнейший элемент женской половой системы, ответственный за созревание яйцеклеток (ооцитов). Именно они являются основой для воспроизведения рода. Все остальные процессы в репродуктивных органах направлены на создание благоприятных условий для зачатия и последующей беременности. А обеспечивается это циклически меняющимся уровнем половых гормонов, которые находятся во взаимном балансе и тоже вырабатываются в яичниках. Поэтому выраженное снижение функциональной активности нормально развитых женских гонад или значительное повреждение их ткани всегда приводит к снижению фертильности женщины.
Бесплодие при этом связано как с нарушением ежемесячного процесса созревания и овуляции ооцитов, так и с недостаточной «подготовленностью» матки к имплантации оплодотворенных яйцеклеток. Так что проблемы с наступлением и сохранением беременности – обязательный компонент синдрома овариальной недостаточности.
Можно ли забеременеть при гипофункции яичников, зависит от выраженности и потенциальной обратимости имеющихся у женщины изменений. При этом в большинстве случаев для успешного зачатия необходимо не курсовое, а постоянное поддерживающее лечения. А иногда пациентке требуется не только медикаментозная коррекция, но и использование высокотехнологичных вспомогательных репродуктивных методик. Если же овариальная гипофункция приводит к первичной аменорее с выраженной гипоплазией половых органов, прогноз в отношении достижения фертильности обычно сомнительный. В этом случае, даже если удается добиться созревания яйцеклеток, нередко требуются услуги суррогатной матери.
Негормональная терапия
Естественно, без гормонального лечения обойтись нельзя, однако, необходимо воспользоваться и другими методами терапии:
- Физиотерапевтическими процедурами. Именно они помогают стимулировать развитие половых органов. Следует использовать именно те процедуры, которые способствуют улучшению кровообращения.
- Лечебной физкультуры.
- Витаминной терапии. Такой метод лечения необходим во время активного формирования циклических изменений в яичниках. Пациентке придется принимать витамины С, Е, фолиевую кислоту, магний и цинк.
- Народные методы. Существуют различные гинекологические сборы, которые применяются для активизации образования и созревания фолликулов. Также народные средства уменьшают выраженность признаков. Популярным является сбор, в котором содержится боровая матка. Она издавна считается «женской» травой. Хорошо помогает родиола розовая, левзея, красная щетка, шиповник, омела, солодка, аир. Достаточно популярным является сбор «Аленький цветочек».
Гипофункция — это сложная многогранная проблема. Пострадать может любая пациентка, независимо от возраста. Своевременное лечение патологии может избавить от большинства ее форм.
Как лечить гипофункцию яичников
Лечение гипофункции яичников может быть направлено на решение нескольких задач:
- Нормализация менструального цикла.
- Восстановление фертильности (если женщина планирует беременность). Это можно достигнуть при коррекции гормонального фона (с приближением его к физиологическому уровню), активации созревания и овуляции яйцеклеток, нормализации размера матки и толщины функционального слоя эндометрия.
- Инициирование начала полового созревания с появлением вторичных половых признаков. Это актуально при врожденной гипофункции яичников первичного или вторичного характера, в том числе обусловленной хромосомными аномалиями.
- Коррекция проявлений эстрогеновой недостаточности: субатрофии и сухости слизистой вульвовагинальной области, вегетососудистых и психоэмоциональных нарушений, остеопоротических изменений костей.
Лечение при овариальной гипофункции должно назначаться с учетом типа расстройств и поставленных задач. При этом у молодых пациенток в некоторых случаях бывает целесообразно проведение поэтапной терапии, когда вначале проводят коррекцию дизгормональных нарушений и лишь затем решают вопрос о возможности наступления беременности.
При первичной овариальной недостаточности основой лечения является эстрогензаместительная терапия, которую при необходимости дополняют мерами для коррекции последствий гипоэстрогении. Первоначально проводят эстрогенизацию с использованием монокомпонентных гормональных препаратов, в последующем переходят на комбирированные эстроген-гестагенные варианты. После достижения клинического эффекта рекомендуется переводить пациентку на низкодозированные средства для минимизации побочных явлений такой длительной поддерживающей терапии. С этой целью назначается, например, Ярина. Такое лечение проводится до достижения женщиной возраста среднестатистической менопаузы.
Низкодозированный эстроген-гестагенный контрацептивный препарат «Ярина»
При вторичной форме овариальной гипофункции препараты подбираются с учетом чувствительности к гестагенам и эстрогенам, что определяется посредством проб. У девочек с задержкой полового созревания первоначально используется стимулирующая схема для инициации роста репродуктивных органов и запуска менархе. В последующем им подбирается поддерживающая терапия, позволяющая имитировать естественный женский гормональный фон.
Планирование беременности возможно лишь после восстановления менструального цикла и достижения циклических изменений овариальной ткани. В большинстве случаев для этого проводят стимуляцию созревании яйцеклетки и последующую провокацию ее овуляции (подробнее, в статье по ссылке). Используемые терапевтические схемы подбираются индивидуально, нередко в рамках протокола ЭКО.
Негормональное лечение
Разные схемы гормонотерапии являются основой для коррекции любой формы овариальной недостаточности. Но при лечении дополнительно могут быть использованы и другие средства. К ним относят:
- Физиотерапия. Ее применение актуально на этапе стимуляции развития половых органов. Предпочтение отдают методикам, направленным на улучшение кровообращения в органах малого таза.
- ЛФК, задачей которого тоже является улучшение кровоснабжения внутренних половых органов.
- Витаминотерапия, чаще всего назначаемая на этапе активной коррекции работы яичников с провоцированием в них циклических изменений и созревания ооцитов. При этом используются специальные циклические схемы применения определенных минералов и витаминов: цинка, магния, витаминов С, Е, группы В, фолиевой кислоты.
- Применение лекарственных растений и их сборов. Лечение гипофункции яичников народными средствами может быть направлено на уменьшение выраженности психовегетативных проявлений гипоэстрогении и на активацию фолликулогенеза. Используются различные сборы на основе боровой матки, родиолы розовой, красной щетки, левзеи, омелы, шиповника, болотного аира, солодки и других растений.
Гипофункция яичников – достаточно часто диагностируемая и многофакторная патология. Причем ей могут быть подвержены пациентки любого возраста: и уже имеющие детей, и еще только вступающие в репродуктивный возраст. Многие формы овариальной недостаточности поддаются медикаментозной коррекции, и женщинам на фоне адекватно подобранной терапии нередко даже удается зачать и благополучно выносить ребенка. Но не стоит забывать, что лечение должен подбирать только врач после комплексного полноценного обследования и уточнения патогенетического типа и степени гипофункции яичников.
Лечение
Терапия ставит перед собой определенные задачи.
Прежде всего, это нормализация сбитого менструального цикла и восстановление репродуктивных возможностей, если женщина еще планирует стать мамой.
Здесь применяется гормональная терапия. В зависимости от ситуации медики стимулируют овуляцию. Такая тактика актуальна, если проблема – врожденная. Еще одним фактором выступает восстановление баланса эстрогена.
Методы принимаются, исходя из общей клинической картины и результатов проведенного обследования. Для пациенток молодого возраста целесообразно проведение терапии в несколько этапов. Изначально проводится коррекция дизгормональных нарушений, а только потом решается можно ли забеременеть.
Если выявлен первичный тип заболевания, то уместно восстановить баланс эстрогенов. Для этого типа лечения используются определенные препараты. Чтобы достичь максимального эффекта, то дозировка должна быть невысокой, поскольку существует риск побочных явлений. Часто назначается противозачаточный препарат Ярина.
В случае диагностики вторичной формы, то препараты нужно подобрать на основе индивидуальной чувствительности к эстрогенам и гестагенов. Эти показатели определяются посредством взятия проб. Для тех девочек, у которых длительное время не наступает первая менструация, применяется схема стимуляции роста репродуктивных органов.