Вследствие высокой заболеваемости и смертности трудности в постановке диагноза и лечении опухолевых процессов являются одной из главных проблем в медицине, а правильная и своевременная их диагностика, проведенная в соответствии с современными системами классификации, позволяет избежать ряда тяжелых осложнений. Показано, что распространенность злокачественных новообразований щитовидной железы с 2006 по 2021 г. возросла с 66 до 105 на 100 000 населения, а к окончанию 2021 г. количество пациентов, состоящих на учете по данной патологии, составило 154 824 [1].
Согласно новой Международной классификации опухолей эндокринной системы, для инкапсулированных опухолей щитовидной железы с отсутствием капсулярной и/или сосудистой инвазии, а также изменением ядер опухолевых клеток, характерных для папиллярного рака щитовидной железы, введена классификационная категория «неинвазивная фолликулярная опухоль щитовидной железы с ядрами папиллярного типа» (НИФОЯПТ). Эта категория входит в группу «другие инкапсулированные опухоли щитовидной железы фолликулярного строения» [2]. Исследования показали медленное и благоприятное клиническое течение НИФОЯПТ, поэтому в данное время ее относят к доброкачественным новообразованиям щитовидной железы. Это свидетельствует о том, что лечение пациентов с НИФОЯПТ может быть сведено к минимальному, а именно к гемитиреоидэктомии, а тотальная тиреоидэктомия и радиойодтерапия не имеют при данной патологии никаких преимуществ. В дополнение к отсутствию психологической нагрузки от диагноза «рак» снижаются количество осложнений, которые могут возникнуть после тотальной тиреоидэктомии, а также риск возникновения вторичных опухолей после радиойодтерапии [3]. Такой подход повышает ответственность лечащего врача и врача-патологоанатома при постановке диагноза НИФОЯПТ и требует наличия комплекса четких морфологических критериев. Ниже представлено клиническое наблюдение, знакомство с которым считаем полезным для диагностики и определения тактики лечения данной патологии.
У женщины 36 лет выявлено узловое образование в левой доле щитовидной железы. При пальпации левой доли определялся узел размером 2×2×1 см с четкими контурами, мягкоэластической консистенции, подвижный при глотании. Лимфатические узлы шеи не увеличены. По результатам функциональных тестов и с помощью радиоиммунологического анализа выявлены следующие отклонения: повышенный уровень тиреотропного гормона — 6,6 мкМЕ/мл (при норме 0,27—4,0 мкМЕ/мл), сниженный уровень свободного Т4 — 0,71 нг/дл (при норме 0,8—2,1 нг/дл), повышенный уровень антител к тиреопероксидазе — 393,6 МЕ/мл (при норме 0—35 МЕ/мл). По данным ультразвукового исследования в левой доле железы, ближе к верхнему полюсу обнаружено неоднородное, окруженное капсулой, изоэхогенное образование размером 22×13×15 мм с выраженной васкуляризацией, участком гипоэхогенной структуры по периферии (рис. 1).
Рис. 1. Ультразвуковое исследование щитовидной железы. Регионарные лимфатические узлы не увеличены. Пациентке выполнена тонкоигольная аспирационная биопсия узлового образования, по результатам которой сделано заключение: материал многоклеточный, обнаружено большое количество фолликулярных структур, в некоторых из которых определяется коллоид. В отдельных полях зрения встречаются единичные атипичные микрофолликулярные структуры из полиморфных тиреоцитов с напластованием ядер, наличием крупных, полиморфных, преимущественно центрально-расположенных ядрышек (рис. 2).
Рис. 2. Микрофолликулярные структуры опухоли, атипичная микрофолликулярная структура, окраска по Паппенгейму, ×200. Рис. 2. Микрофолликулярные структуры опухоли, атипичная микрофолликулярная структура, окраска по Паппенгейму, ×200. Выполнена левосторонняя гемитиреоидэктомия и при макроскопическом исследовании в области верхнего полюса железы выявлено инкапсулированное узловое образование размером 22×13×15 мм, серо-желтого цвета. Ткань щитовидной железы фиксировали в течение 24 ч в 10% растворе формалина, после чего фрагменты ткани толщиной 2—3 мм укладывали в кассеты. Окраску гистологических срезов толщиной 4—5 мкм осуществляли гематоксилином и эозином. При микроскопическом исследовании установлено, что на фоне хронического тиреоидита в левой доле железы определяется опухоль, имеющая микрофолликулярное и нормофолликулярное строение, окруженная очагово-утолщенной за счет фиброза интактной на всем протяжении соединительнотканной капсулой (рис. 3).
Рис. 3. Интактная капсула опухоли. Рис. 3. Интактная капсула опухоли. Несмотря на фолликулярное строение, в опухоли можно выделить два компонента: первый занимает преимущественно центральные отделы опухоли, составляет около 40% и представлен фолликулами, выстланными мономорфными тиреоцитами с гиперхромными ядрами, второй занимает периферические отделы опухоли, составляет около 60%, и представлен фолликулами, выстланными полиморфными тиреоцитами с просветленными ядрами, в которых определяются псевдовключения, борозды и напластование ядер клеток (рис. 4).
Рис. 4. Внутриядерное включение в клетке опухоли. Рис. 4. Внутриядерное включение в клетке опухоли. Опухолевые фолликулы обоих компонентов заполнены эозинофильным коллоидом, а строма опухоли представлена тонкими прослойками соединительной ткани со слабовыраженной лимфоидной инфильтрацией. Фокусов инвазии опухоли в кровеносные и лимфатические сосуды, псаммомных телец и фигур митоза в клетках опухоли не обнаружено. На основании патогистологического исследования выставлен диагноз НИФОЯПТ. При иммуногистохимическом исследовании маркеров злокачественности в клетках опухоли выявлена очаговая экспрессия галектина-3 (рис. 5),
Рис. 5. Очаговая экспрессия галектина-3 в клетках опухоли, ×400. Рис. 5. Очаговая экспрессия галектина-3 в клетках опухоли, ×400. HBME-1 (рис. 6)
Рис. 6. Очаговая экспрессия HBME-1 в клетках опухоли, ×400. Рис. 6. Очаговая экспрессия HBME-1 в клетках опухоли, ×400. в опухолевом компоненте, состоящем из клеток с ядрами папиллярного типа, что свидетельствует о иммунофенотипической гетерогенности опухоли в морфологически однородном клеточном составе. Проведено молекулярно-генетическое исследование выделенной из парафиновых блоков ДНК с использованием аллельспецифической полимеразной цепной реакции (ПЦР) в реальном времени для выявления мутации V600E гена
BRAF
, а также мутационно-специфической ПЦР с последующим секвенированием по Сэнгеру для характеристики мутационного статуса 15-го экзона гена
BRAF
, 2—4 экзонов генов
NRAS
и
KRAS
и 2—3 экзонов гена
HRAS
. Ни в одном из исследуемых генов мутаций не выявлено. Также не было выявлено транслокаций RET/PTC1 и RET/PTC3.
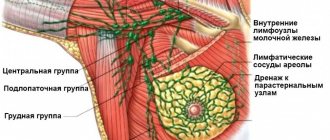
Неинвазивный рак молочной железы
Внутрипротоковый рак (протоковый рак in situ)
По сути это внутрипротоковая карцинома, которая рассматривается как предвестник инвазивной карциномы. Это не значит, что каждый инвазивный рак молочной железы (РМЖ)
проходит стадию рака in situ, однако риск развития инвазивных форм на фоне рака in situ высокий.
Проведение оперативной и/или лучевой терапии позволяет вылечить пациентов. Это та форма рака, которую желательно активно выявлять при маммографических исследованиях.
Улучшение качества скрининга во многих европейских странах привело к тому, что ежегодный прирост рака in situ с 1973 по 1983 г. составлял 3,9% , а с 1983 по 1992 г. — 17,5%. Показатель этого заболевания в 1973 г. составил 2,4 на 100 тыс. женского населения, а в 1992 г. — 15,8.
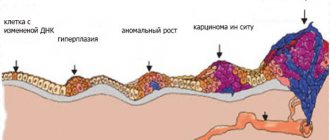
Рак in situ часто представлен в виде отдельных очагов поражения, разделенных прослойками ткани молочной железы. В зависимости от ядерной атипии, полиморфизма клеток, количества атипических митозов, наличия очагов некроза в протоках, кальцинатов и их количества рак in situ разделяют на три степени дифференцировки. Поэтому в патологоанатомическом заключении должна быть характеристика опухоли по нижеприведенным параметрам.
Патологоанатомическое описание внутрипротоковой карциномы:
• тканевая архитектоника (количество и размеры микроочагов карциномы и фон, на котором произошло развитие); • выраженность атипии ядер; • наличие некрозов; • узловое или диффузное поражение (размеры и количество узлов); • расстояние очагов карциномы от края резекции; • наличие микрокальцинатов (их расположение непосредственно в очаге карциномы или за пределами).
Внутрипротоковый рак высокой степени дифференцировки или низкой степени злокачественности (low grade ductal carcinoma in situ G1)
Рак in situ Gl состоит из мелких мономорфных клеток, растущих в виде папиллярных, криброзных, солидных структур внутри протоков молочной железы. Ядра полиморфны, некоторые гиперхромные с четкими нуклеолами, фигуры митоза редки.
Пролифераты могут отмечать в одном или нескольких протоках. Между ними прослойки ткани молочной железы или чаще протоковой неоплазии разной степени дифференцировки. Очаги поражения, как правило, небольшие, максимум до 2 мм в диаметре.
Микрокальцинаты, наличие десквамированных клеток внутри протоков, некрозы и структуры типа «комедо» для этой стадии дифференцировки нехарактерны. Наиболее часто отмечают микропапиллярные и криброзные структуры (фото 25).
Фото 25. Рак in situ G1. Опухолевые клетки формируют криброзные внутрипротоковые структуры. Гематоксилин-эозин, х 200
Внутрипротоковый рак умеренной степени дифференцировки (intermediate grade ductal carcinoma in situ G2)
Рак in situ G2 состоит из мелких полиморфных клеток, растущих внутри протоков молочной железы в виде папиллярных, криброзных, солидных структур. В отличие от предыдущего варианта, для рака in situ G2 более характерны солидные структуры, структуры типа «комедо», как при угревидном раке (фото 26).
Фото 26. Рак in situ G2. В участке рака отмечают десквамацию эпителия, формирование структуры типа «комедо». В ткани, окружающей внутрипротоковый рак, изменения, характерные для дольково-протоковой гиперплазии молочной железы. Гематоксилин-эозин, х 200
Ядра полиморфны, гиперхромные с грубодисперсным хроматином, чаще отмечают фигуры митоза. Возможны очаги некроза, микрокальцинаты, однако эти признаки необязательны. Очаги карциномы небольшие, как и при раке in situ G1.
Внутрипротоковый рак низкой степени дифференцировки (high grade ductal carcinoma in situ G3)
Рак in situ G3, в отличие от предыдущих вариантов дифференцировки, имеет более крупные очаги поражения, часто до 5 мм, по помимо крупных очагов возможны единичные мелкие, иногда менее 1 мм. Структура компоновки клеток в протоке такая же, то есть наличие папиллярных, криброзных и солидных форм роста с преобладанием солидных структур.
В раке in situ G3 клетки более полиморфны, отмечают много полигональных клеток разного размера. Преобладают клетки большого размера, особенно в очагах пролиферации. Ядра гиперхромные, атипичные, много фигур митоза. Часто отмечают некрозы и микрокальцинаты, которые могут быть расположены фокально или диффузно в просвете протоков. Цитологическая характеристика опухолевых клеток рака in situ G3 близка к характеристике клеток инвазивной карциномы (фото 27-28а).
Фото 27. Рак in situ G3. В поле зрения несколько протоков с раком in situ, в одном из них — микрокальцинаты, в верхнем протоке — очаг некроза. Гематоксилин-эозин, х 100
Фото 28. Рак in situ G3. Опухолевые клетки крупные, заполняют просвет протоков полностью, формируя солидные структуры. Гематоксилин-эозин, х 200
Фото 28а. Протоковый рак in situ. Миоэпителиальный слой сохранен в виде непрерывного слоя (коричневая линия на фото). Экспрессия гладкомышечного актина (клон HHF35, производство DAKO). Иммуногистохимическое окрашивание, система визуализации EnVision, хромоген DAB. Миоэпителиальные клетки в виде непрерывной линии вдоль базальной мембраны, часть этих клеток вошли в сосочковую структуру внутри протока, х 200
Основным для верификации рака in situ любой степени дифференцировки является достоверное определение отсутствия микроинвазии опухоли в строму. Для этого необходимо исследовать большое количество срезов и использовать иммуногистохимический метод для окраски базальной мембраны и миоэпителиальных клеток.
Необходимо обратить внимание на изменение структуры стромы, которая реагирует на инвазию опухоли и лим-фоплазмоцитарную инфильтрацию вокруг очагов инвазии опухоли.
Следует отметить, что морфологический код в Международном классификаторе онкологических заболеваний для рака in situ всех степеней дифференцировки одинаков — 8500/2.
Особыми вариантами рака in situ являются верстеноклеточный, апокриновый, перстневидный, нейроэндокринный, плоскоклеточный и светлоклеточный. Эти варианты отражены в классификации ВОЗ (2003), однако выявляются очень редко.
Пролиферативную активность в настоящее время часто исследуют с помощью антитела Ki 67. В раке in situ G3 со структурами «комедо» индекс пролиферации составляет 13%, в раке in situ G1 в среднем 4,5%, а в микропапиллярном раке высокой степени дифференцировки часто может быть нулевым.
Для дифференциальной диагностики протоковой и дольковой неоплазии применяют иммуногистохимическое исследование. E-cadherin всегда экспрессируется в протоковых неоплазиях, a cytokeratin 1/5/10/14 (clon CK34BetaE12) в большинстве случаев дает негативную реакцию (92%). В лобулярной неоплазии все наоборот. Нет экспрессии E-cadherin, a cytokeratin 1/5/10/14 (clon CK34BetaE12) выявляют почти всегда.
Клиническая картина
При маммарном раке симптоматика бывает специфической, в зависимости от вида опухоли, и общей для любого типа онкопроцесса. Специфические признаки:
- Инвазивная протоковая карцинома – деформируется сосок, из него сочится патологическая жидкость.
- Дольковый рак – возникает болезненное уплотнение с бугристой поверхностью. Грудь сморщивается, сосок втягивается.
- Воспалительная карцинома – имеет признаки мастита, что может затруднять диагностику.
- Карцинома Педжета – в районе соска возникает хроническая экзема.
К общим симптомам и признакам заболевания относится гипертермия, потеря аппетита и веса, а также анемия. Грудные железы становятся асимметричными, у них может быть разный размер и форма. Также симптомы проявляются на коже, она изменяет цвет и становится красноватой, желтой, с синим оттенком. Стоит помнить, что на начальных стадиях развития карцинома может протекать скрытно, без каких-либо болей и визуальных признаков, поэтому часто патология диагностируется уже в запущенной форме.
Внутрикистозный папиллярный рак
Выявляют чаще у женщин пожилого возраста (в среднем 65 лет), составляет 2% всех случаев РМЖ. Размеры опухоли могут быть большие — от 0,4 до 10 см, в среднем 2 см.
Прежде всего опухоль представлена кистой и папиллярным раком в виде небольшого участка в кисте или замещающим почти всю полость кисты. Морфологическое строение характерно для внутрипапиллярного рака, то есть представлено фиброваскулярными лучиками, лишенными миоэпителиальной выстилки и покрытыми неоплазированным эпителием, соответствующим дифференцировке G1.
Атипичный эпителий формирует солидные, криброзные, папиллярные структуры. Миоэпителиальная выстилка сохранена только в стенке кисты неопухолевого строения. Возможна продукция муцина (фото 29).
Фото 29. Участок внутрикистозного папиллярного рака с выраженными признаками секреции. Гематоксилин-эозин, х 100
Бывают участки метаплазии, участки клеток нейроэндокринной дифференцировки. Характерной особенностью является отсутствие инвазии опухоли в окружающую строму (фото 30).
Фото 30. Участок стенки кисты внутрикистозного папиллярного рака. Эпителиальная выстилка кисты малигнизирована и представлена микрососочковыми структурами. Нет признаков опухолевой инвазии в фиброзную капсулу кисты. Гематоксилин-эозин, х 100
Морфологический код в Международном классификаторе онкологических заболеваний папиллярного рака внутри кисты — 8504/2.
Прогноз и профилактика
Прогноз при раке груди зависит от стадии, на которой была начата терапия.
- При карциноме первой стадии пятилетняя выживаемость обеспечена девяноста женщинам из ста,
- Если обнаружен рак молочной железы 2 стадии, то процент пятилетней выживаемости падает до шестидесяти шести,
- При третьей стадии выживаемость составляет не более сорока одного процента,
- После лечения четвертой стадии только десять процентов женщин могут рассчитывать на пятилетнюю выживаемость.
По злокачественности только до степени G2 прогноз относительно благоприятный. Предотвращение рецидива от рака, инфильтрующего во вторую молочную железу, возможно только посредством удаления двух грудей. Профилактика заключается в избежании факторов риска.
Инвазивный рак шейки матки – что это такое? Рак шейки матки занимает третье место среди всех злокачественных новообразований, которые поражают женщин репродуктивного возраста. На начальной стадии патологического процесса определяется неинвазивный рак шейки матки. В этом случае атипичные клетки растут медленно и распространяются в пределах слизистой шейки матки. Инвазивный рак шейки матки характеризуется интенсивным ростом клеток. Он может распространяться на другие органы и нарушать их функционирование. Процесс перехода неинвазивного рака шейки матки в инвазивный длится до 20 лет, но он неизбежен. Гинекологи Юсуповской больницы проводят своевременную диагностику заболевания с помощью новейшей аппаратуры ведущих мировых производителей?
Раннее лечение неинвазивного и микроинвазивного рака шейки матки позволяет улучшить прогноз пятилетней выживаемости. В Юсуповской больнице работает команда специалистов высокой квалификации: онкологи-гинекологи, химиотерапевты, радиологи. Врачи проводят лечение неинвазивного, преинвазивного и инвазивного рака шейки матки в соответствии со стандартами ASCO и NCCN. Профессиональный уход осуществляют медицинские сёстры, которые знают особенности течения ракового процесса, внимательно относятся к пожеланиям пациентов и их родственников.