Метод экстракорпорального оплодотворения давно перешел из мира фантастики в современную реальность. Ведь огромное количество мужчин и женщин смогли с его помощью осуществить мечту стать родителями.
Все этапы такой беременности по сути такие же, как и при естественном оплодотворении. Однако между ними есть одна существенная разница: ЭКО создает оптимальные условия для успешного зачатия. Одно из таких искусственно созданных условий – стимуляция перед ЭКО. Благодаря стимуляции репродуктологи имеют возможность получить максимально возможное количество зрелых жизнеспособных яйцеклеток, что увеличивает шансы наступления беременности в разы.
Что такое программа экстракорпорального оплодотворения?
Благодаря революционному развитию вспомогательных репродуктивных технологий появился способ лечения бесплодия, подаривший большие надежды бесплодным супружеским парам. Это – метод экстракорпорального оплодотворения, перенос эмбрионов, который на сегодняшний день является самым эффективным методом лечения бесплодия, помогающим даже при самых, казалось бы, безнадежных ситуациях. ЭКО, имплантация эмбриона применяется при абсолютном женском бесплодии (при отсутствии или полной непроходимости обеих маточных труб), при мужском бесплодии, при бесплодии неясной причины, а также при неэффективном консервативном или оперативном лечении других форм бесплодия. Поэтому врачи считают, что продолжать лечение бесплодия другими методами более 1,5–2 лет, если очевидна их неэффективность, нельзя. Чем раньше пара обратится в клинику экстракорпорального оплодотворения, тем выше у нее шансы на успех. При экстракорпоральном оплодотворении после стимуляции яичников у женщины созревает несколько фолликулов с яйцеклетками. Непосредственно экстракорпоральное оплодотворение проводится таким образом: врач пунктирует яичник, извлекая яйцеклетки, которые затем оплодотворяются спермой мужа или донора вне организма матери. При сниженном качестве спермы супруга производится введение единичного сперматозоида с помощью микроиглы (метод ИКСИ). Через несколько дней производится перенос эмбрионов: получившиеся благодаря ЭКО оплодотворению эмбрионы переносятся в полость матки женщины. Далее происходит прикрепление эмбриона и эмбрион в матке продолжает свое развитие. После подсадки эмбрионов одна попытка ЭКО оплодотворения, имплантация эмбриона дает вероятность зачатия от 20 % до 30 %, что даже несколько выше средней частоты наступления беременности естественным путем. Вероятность зачатия и успешное развитие эмбриона при проведении процедуры после подсадки эмбрионов зависит от возраста супругов, состояния их здоровья, качества применяемых препаратов, качества полученных эмбрионов, а также некоторых других факторов. Правильный день имплантации эмбриона назначает врач-специалист. После подсадки эмбрионов, дни после переноса эмбрионов должны проходить под контролем специалиста. Неудача одной попытки ЭКО оплодотворения еще не означает, что данный метод – перенос эмбрионов — оказался неэффективным. Каждая последующая попытка ЭКО, имплантация эмбриона существенно увеличивает суммарные шансы наступления успешной беременности после подсадки эмбрионов. За год лечения экстракорпоральное оплодотворение после подсадки эмбрионов дает практически девяностопроцентный шанс забеременеть. За три десятилетия, прошедшие с момента рождения англичанки Луизы Браун, первого ребенка, появившегося из яйцеклетки, оплодотворенной «в пробирке» (1978 г.), более трех миллионов детей появились на свет с помощью данного метода. Современные вспомогательные репродуктивные технологии, перенос эмбрионов уже помогли миллионам бесплодных пар по всему миру. Мы надеемся, что Вам они тоже помогут. Если у Вас нет денежных средств на перенос эмбрионов, то можно попробовать провести экстракорпоральное оплодотворение бесплатно, осуществить перенос эмбрионов, воспользовавшись специальной государственной программой. Однако следует помнить, что экстракорпоральное оплодотворение бесплатно дается намного сложнее, чем платная процедура — так как при неудачной попытке Вы будете долго ждать следующего шанса получить бесплатное экстракорпоральное оплодотворение. Желаем удачи!
Эффективность короткого протокола ЭКО
При сравнении эффективности короткого и длинного протокола выявляется следующая закономерность:
Короткий протокол более показан при мужском бесплодии, в то время как у женщины нарушения в репродуктивной системе минимальные. В таком случае после стимуляции в яичниках созревают полноценные, годные к оплодотворению ооциты.
Щадящие схемы короткого протокола с малой гормональной нагрузкой не дают гарантий равномерного созревания всех фолликулов, и часто после пункции врачу трудно отобрать для ЭКО зрелые и жизнеспособные яйцеклетки.
Важно. По статистике при длинном протоколе шансы на успешное зачатие выше, чем при коротком.
Схема программы. Имплантация эмбриона. До и после подсадки эмбрионов
Программа ЭКО состоит из нескольких этапов. Каждый из этапов по-своему важен, соответственно, относиться к нему нужно очень ответственно, точно выполняя все рекомендации врача.
I этап Определение программы экстракорпорального оплодотворения, включая тактику лечения после проведения предварительного обследования.
II этап Подготовка супругов к столь важной процедуре, как ЭКО оплодотворение: коррекция гормональных отклонений, включая нарушения сперматогенеза, лечение инфекций
III этап Стимуляция суперовуляции, ультразвуковой мониторинг (10–30 дней).
IV этап Введение человеческого хорионического гонадотропина (чХГ ) для окончательного созревания яйцеклеток перед проведением экстракорпорального оплодотворения (1 день).
V этап Пункция фолликулов, забор яйцеклеток, сдача спермы. Оплодотворение яйцеклетки спермой супруга или донора (1день). VI этап Культивирование эмбрионов, наблюдение за дроблением эмбрионов (2–5 дней).
VII этап В выбранный день переноса эмбрионов — перенос эмбрионов в полость матки, после подсадки эмбрионов — замораживание оставшихся эмбрионов по необходимости (1 день).
VIII этап Дни после переноса эмбрионов — гормональная поддержка беременности ранних сроков после подсадки эмбрионов. Важно, чтобы прикрепление эмбриона прошло успешно. (до 10-14 недель).
IX этап Тест на беременность, связанный с выявлением гормона ХГЧ крови (через 2 недели после подсадки эмбрионов, ЭКО оплодотворения).
X этап УЗИ – диагностика беременности (через 3 недели после подсадки эмбрионов, процедуры экстракорпорального оплодотворения).
XI этап Ведение беременности.
XII этап Роды (родильный дом).
Подготовка к процедуре
Образ жизни для обоих супругов
Для того, чтобы организм был готов к такой процедуре, как перенос эмбрионов и предстоящей беременности, необходимо соблюдать здоровый образ жизни. Питание должно быть разнообразным, богатым витаминами, белками, содержащим умеренное количество жиров, а также углеводов. Никаких строгих диет. Когда нужно сдавать кровь на биохимические или гормональные исследования, позавтракать можно только после забора крови. Показан прием витаминно-минеральных комплексов, предназначенных для беременных. Альтернативой может служить прием фолиевой кислоты, йодида калия, витамина Е небольшими дозами за месяц до начала программы. Избегайте приема лекарственных препаратов, противопоказанных при беременности. Следует исключить курение, даже пассивное. Кофе нельзя пить более двух чашек за день, потребление алкоголя необходимо свести до минимума. Избегайте горячих ванн, бань, саун. Старайтесь вести активный, подвижный образ жизни. Постарайтесь сделать так, чтобы лечение как можно меньше отражалось на вашем настроении. Избегайте выраженных стрессов, а также физического или психологического перенапряжения. После подсадки эмбрионов еще более возрастает значение здорового образа жизни
Половые контакты
Общий характер половой активности на протяжении проведения процедуры экстракорпорального оплодотворения не должен меняться. Вы можете иметь половые контакты с той же частотой, что всегда. Но за 3–4 дня нужно воздержаться от половых актов, чтобы ваш муж накопить достаточное количество спермы. Также супругу следует воздержаться от мастурбации. Воздержание должно продолжаться около семи дней до момента, когда наступит день переноса эмбрионов. Следует избегать половых контактов после подсадки эмбрионов до тестов на беременность, показывающих, что имплантация эмбриона прошла успешно и развитие эмбриона идет должным образом. Обоим супругам нужно стараться избегать случайных половых связей. Обнаруженные половые инфекции необходимо лечить, поэтому последующие половые контакты должны проходить с презервативом. Когда проводится экстракорпоральное оплодотворение, после подсадки эмбрионов из-за увеличения яичников возможна болезненность во время полового контакта.
Минимальное предварительное обследование
Когда вам показана процедура ЭКО, подсадка эмбрионов, ряд исследований можно сделать по месту жительства. Узнайте необходимый минимум обследований. Обычно это спермограмма супруга, гормональный анализ, снимок матки, маточных труб, анализ крови, анализ мазка влагалища на наличие инфекционных заболеваний. Приходя на первичный прием к врачу, не забудьте взять с собой все имеющиеся результаты ранее проведенных обследований, выписки из медицинских карт и т.д. Все это понадобится для того, чтобы имплантация эмбриона прошла успешно. Инфекции Перед проведением процедуры может потребоваться обследование на некоторые инфекции, представляющие после подсадки эмбрионов опасность для зародыша, оказывающие негативное влияние на его развитие, а также на вынашивание беременности. К ним относятся, например, герпес, цитомегаловирус, краснуха, токсоплазмоз. Эти инфекции широко распространены, но часто протекают скрыто. Объем диагностики определяет лечащий врач.
Гормональное обследование Часто бесплодию сопутствуют гормональные отклонения. Их своевременное выявление, а также коррекция позволяют повысить не только вероятность наступления беременности после подсадки эмбрионов, но и шансы на ее благоприятное течение. Большинство гормонов исследуются с 1-го по 5-й день менструального цикла. Поэтому первый визит должен приходиться на этот период. Кровь сдается из вены, как правило, утром, натощак.
Посещение андролога, исследование спермы
Лечение бесплодия методом ЭКО подразумевает обязательное обследование у андролога, включая исследование спермы. Перед анализом спермы супругу необходимо соблюдать некоторые правила: воздерживаться от половой жизни от 3 до 7 дней (оптимально 5), нельзя пить спиртное, нельзя париться, никаких горячих ванн, нельзя мочиться два часа до посещения врача, употребляйте только нежирную, неострую пищу.
Планирование визитов к врачу Лечение методом ЭКО, подсадка эмбрионов проходит амбулаторно, но требует от пациентов дисциплины, пунктуальности. Перед началом программы спланируйте свои дела таким образом, чтобы у вас не было ночных дежурств, чтобы вы смогли пройти стимуляцию овуляции (на протяжении 2–4 недель), а затем прийти на пункцию и перенос эмбрионов в день имплантации эмбриона. Присутствие мужа требуется для предварительного обследования, сдачи спермы при пункции фолликулов. После переноса эмбрионов вам будет выписан больничный лист.
Соглашения Если вы планируете начать лечение методом ЭКО или другими методами вспомогательной репродукции, к которым относятся ИКСИ, искусственная инсеминация, оплодотворение донорской спермой, донация яйцеклеток, суррогатное материнство, то предварительно решите с врачом все волнующие вас как этические, а также юридические вопросы. На каждый вид лечения с клиникой заключается юридическое соглашение, которое должно подписываться обоими супругами.
Возможности улучшения результативности ЭКО и ПЭ у пациенток старшего репродуктивного возраста
Распространенность бесплодного брака в России — более 15%, и эта цифра растет из года в год. Именно поэтому этой проблеме уделяется все большее внимание на уровне государства в рамках поддержки современных медицинских технологий, в том числе и программ, направленных на преодоление бесплодия, от которых ждут достаточно высоких конечных результатов: процент наступления беременности и увеличения количества «take baby home» на профинансированные циклы. В последние годы наметилась тенденция к увеличению среди супружеских пар доли пациенток позднего репродуктивного возраста, которые обращаются с целью достижения беременности и рождения ребенка (по данным Американской ассоциации репродуктивной медицины (American society reproductive medicine, ASRM) — до 12,3%). По данным Регистра Российской ассоциации репродукции человека (РАРЧ) от 2014 г., процент пациенток старше 40 лет, которым проведены программы экстракорпорального оплодотворения (ЭКО)/интрацитоплазматической инъекции сперматозоидов (ИКСИ), составил 15,05%, криопереноса эмбрионов (ПЭ) — 11,3%, программ, выполненных с использованием донорских ооцитов (ДО) в возрастной группе старше 40 лет, составил 49,7% [1]. Демографические исследования ряда стран показывают, что по различным социально-экономическим причинам все большее число женщин откладывают беременность на конец репродуктивного периода. Женщины стремятся к получению высшего образования, имеют интенсивный график работы вне дома, поздно выходят замуж и не торопятся рожать детей (Боярский К. Ю., 2009) [2]. Кроме того, обращение ряда пациенток в более позднем репродуктивном возрасте обусловлено такими социальными аспектами, как гибель ребенка (детей), повторный брак. Основной причиной обращаемости пациенток позднего репродуктивного возраста по поводу бесплодия по данным Т. А. Назаренко и Н. Г. Мишиевой (2014) является повторный брак — 42%. 40% женщин обратились по поводу лечения бесплодия в раннем репродуктивном возрасте, однако длительное неэффективное лечение в течение 10 лет и более со сменой ряда лечебных учреждений привело к тому, что за специализированной помощью эти пациентки обратились уже в позднем репродуктивном возрасте. Отсроченное деторождение по желанию женщины составило лишь 13%, гибель единственного ребенка была мотивацией для 5% женщин. Установленные причины обращаемости представлены на рис. 1 [3].
Эффективность программ ЭКО во многом определяют возраст и овариальный резерв. Овариальный резерв у пациенток старшей возрастной группы, как правило, снижен. Под овариальным резервом понимают функциональный резерв яичника, который определяет способность последнего к развитию здорового фолликула с полноценной яйцеклеткой (Боярский К. Ю., 2005). Показателями низкого овариального резерва (Назаренко Т. А., Краснопольская К. В., 2012) — предиктора бедного ответа яичников на стимуляцию суперовуляции являются следующие параметры: возраст старше 35 лет; длительность менструального цикла 24–26 дней; уровень фолликулостимулирующего гормона (ФСГ) более 10 МЕ; число базальных фолликулов менее 10 мм на 2–3 день цикла менее 5 в каждом яичнике; объем яичников — менее 8 см3 [4]. На сегодняшний день прогнозировать бедный ответ яичников принято на основании рекомендаций Европейского общества репродукции человека и эмбриологии (European Society of Human Reproduction and Embryology, ESHRE, Болонские критерии), которые включают в себя:
- предыдущий эпизод слабого ответа яичников (≤ 3 ооцитов) при стандартных дозировках гонадотропинов;
- аномальный овариальный резерв с количеством антральных фолликулов < 5–7 или антимюллеровый гормон (АМГ) < 0,5–1,1 нг/мл;
- женщины старше 40 лет или наличие других факторов риска плохого ответа, таких как операции на яичниках, генетические дефекты, химиотерапия, лучевая терапия и аутоиммунные заболевания.
Пациентки, у которых имеются по крайней мере два из следующих критериев, относят в группу с низким овариальным резервом и, как следствие, бедного ответа.
Средняя эффективность использования методов вспомогательной репродукции на один лечебный цикл составляет 30–35% (Кулаков В. И. и соавт., 2000), по данным регистра РАРЧ (2014) — 40%. Однако эти показатели не относятся к группе пациенток старше 35 лет (старший репродуктивный возраст), имеющих в основном сниженные показатели овариального резерва и низкую эффективность программ ЭКО — менее 10–20% (Назаренко Т. А., Краснопольская К. В., 2012; Никитин С. В. и соавт., 2015; Рудакова Е. Б. и соавт., 2015 и др.). В работе, проведенной в отделении вспомогательных репродуктивных технологий МОПЦ, Балашиха, по сравнению биологических показателей циклов ЭКО за 2014 г. в возрастных группах до 38 лет (1-я группа) и старше 38 лет (2-я группа), отражены следующие показатели на один лечебный цикл (табл. 1). Количество полученных яйцеклеток составило (р < 0,05): 10,6 ± 5,8 в 1-й группе и 4,7 ± 1,1 во 2-й группе соответственно; количество зрелых яйцеклеток (р < 0,05) — 7,3 ± 4,6 и 3 ± 2,6 соответственно; количество полученных эмбрионов (р < 0,05): 7,4 ± 4,4 и 3,7 ± 1,1 соответственно; количество полученных эмбрионов высшего качества (р < 0,05) — 2,4 ± 2,4 и 1,1 ± 0,3 соответственно. Клиническая беременность наступила в 39,8% в 1-й возрастной группе и 21,4% во 2-й возрастной группе [5].
Улучшить результаты программ ЭКО при «бедном ответе» — это задача, к решению которой приковано внимание всех специалистов, использующих для лечения бесплодия методы вспомогательных репродуктивных технологий. Исследователи предлагают разные варианты и схемы лечения как в качестве предварительной подготовки, так и в процессе стимуляции яичников [6]. Возможными путями решения данной проблемы могут быть различные меры. Использование увеличенных доз гонадотропинов в протоколах стимуляции суперовуляции. Доза индуктора овуляции, как правило, составляет 400–450 МЕ, сочетание рекомбинантного фолликулостимулирующего гормона (рФСГ) и человеческого менопаузального гонадотропина (чМГ) или, наоборот, низкодозовые протоколы стимуляции суперовуляции, так называемые «мягкие» протоколы. Совершенствование протоколов стимуляции суперовуляции (длинный протокол со снижением дозы агонистов рилизинг-гормонов (АГ-РГ); модифицированный протокол с антагонистами гонадотропин-рилизинг-гормона (антГн-РГ), сочетание в протоколе АГ-РГ и антГн-РГ), ЭКО в естественном цикле. Использование современных протоколов с криоконсервацией полученных яйцеклеток с последующим переносом размороженных эмбрионов в цикле заместительной гормональной терапии (двойная стимуляция). Методики применения стимуляторов яичникового ответа до протоколов стимуляции суперовуляции. Применение методики созревания яйцеклеток вне организма (IVM) у пациенток с неудачами ЭКО, в т. ч. при отсутствии зрелых ооцитов.
Сочетание рФСГ и чМГ основывается на наличии в менотропинах лютеинизирующего гормона (ЛГ), что профилактирует повышение эндогенного уровня ЛГ. Аргументом сторонников менотропинов явилась необходимость использования положительных эффектов ЛГ в позднюю фолликулярную фазу при «бедном ответе» [7].
Низкодозовые («мягкие») протоколы стимуляции основаны на назначении небольших доз (100–200 МЕ), если на 7–8 день естественного менструального цикла визуализируется 2–3 фолликула. При достижении фолликулами диаметра 14 мм назначают дополнительно антГн-РГ до дня введения триггера овуляции включительно. «Мягкие» протоколы стимуляции обеспечивают снижение курсовой дозы гонадотропинов, что способствует уменьшению стоимости этапа контролируемой стимуляции в реализации программы ЭКО. Следует отметить, что при применении этих протоколов частота «бедного ответа» заметно возрастает и аргументированно их стоит назначать пациенткам старшего возраста с крайне сниженными показателями овариального резерва и подтвержденным плохим ответом (когда получали не более двух ооцитов) в предыдущих попытках стимуляции с использованием более агрессивных протоколов.
Длинный протокол со снижением дозы АГ-РГ: были сообщения о том, что уменьшение дозы антГн-РГ в 2–4 раза может улучшить ответ яичников и повысить эффективность лечения. Однако убедительных доказательств о преимуществах такой тактики не представлено.
Модифицированный протокол с антГн-РГ: предлагается на 1-й день менструального цикла однократно ввести антГн-РГ (0,25 мг), затем продолжать стимуляцию в обычном режиме и использовать антГн-РГ при достижении фолликулом диаметра 14 мм. Цель этого режима — десенситизация гипоталамо-гипофизарной системы для того, чтобы сформировать пул фолликулов для стимуляции гонадотропинами. Эффективность данной методики достоверно не оценена.
Сочетание в протоколе АГ-РГ и антГн-РГ: при проведении стимуляции яичников антГН-РГ назначают с 19–21 дня предыдущего менструального цикла до 2-го дня последующего, затем подключают гонадотропины. С момента достижения растущими фолликулами диаметра 14 мм назначают антГн-РГ, который используют до момента введения триггера овуляции. Этот протокол не завоевал популярности из-за высокой стоимости и отсутствия преимуществ по сравнению с другими режимами введения препаратов. Наоборот, при использовании описываемой схемы многими специалистами был установлен факт частой отмены циклов.
Двойная стимуляция: при изучении механизмов, приводящих к рекрутированию фолликулов, было обнаружено, что их созревание носит волнообразный характер, и таких волн за цикл всего 3–4, первая из которых начинается в лютеиновую фазу. Поэтому было решено попытаться продолжать стимуляцию малыми дозами гонадотропных гормонов после пункции ооцитов (малые дозы дают равномерный рост большего числа фолликулов, тогда как большие дозы дают резкий рост всего нескольких фолликулов). Это дало свои результаты и позволило в одном цикле получить ооциты два раза. Эмбрионы замораживают и переносят в последующих циклах. Результативность дискутабельна. Рациональность использования этого протокола обусловлена получением большего числа ооцитов за счет двух стимуляций в одном менструальном цикле и соответственно эмбрионов. Однако эту методику отличает большая дороговизна.
Следует отметить, что ЭКО в естественном цикле отличает низкая частота наступления беременности даже у пациенток молодого возраста с вполне нормальным овариальным резервом, поскольку до трети фолликулов могут не содержать полноценную яйцеклетку. Кроме того, для ооцитов, полученных в естественных циклах, характерна относительно невысокая частота оплодотворения (не более 70%), а у полученных из таких ооцитов эмбрионов отмечается невысокая частота дробления (не более 50%) и имплантации (не более 15%). Все это приводит к тому, что результативность таких циклов по показателю частоты наступления беременности на уровне 3–4%. Рекомендация о целесообразности применения методики ЭКО в естественном цикле у женщин старшего репродуктивного возраста имеет такую же аргументацию, как и «мягкие» протоколы — экономия на препаратах гонадотропных гормонов [8].
При использовании IVM, предложенной авторами, получают ооциты при пунктировании фолликулов диаметром 10–12 мм. Далее обеспечивают их дозревание в специальных средах, последующее их оплодотворение (с использованием ИКСИ) и в дальнейшем выполняют перенос полученных эмбрионов или бластоцист [9].
Однако четкой доказательной базы эффективности описанных выше методик пока нет. Есть отдельные обнадеживающие исследования зарубежных и отечественных специалистов (А. А. Смирнова и соавт., 2016; Байкошкарова С. Б. и соавт., 2015; Никитин С. В. и соавт., 2016, С. Ю. Калинченко и соавт., 2016; Kuang Y. et al., 2014; Moffat R. et al, 2014; Ubaldi F. M., 2016) именно у пациенток с низким овариальным резервом старшей возрастной группы с прогнозом «бедного ответа».
Ряд авторов описывает методики применения стимуляторов яичникового ответа до протоколов стимуляции суперовуляции: андрогенный и эстрогенный прайминг, использование гормона роста (СТГ), оральные контрацептивы, заместительная гормональная терапия, гестагены, биологически активные добавки.
По сообщениям Е. В. Крстич (2010) и К. В. Краснопольской и соавт. (2010), «андрогенный прайминг» полезен именно для тех «возрастных» пациенток, у которых имеет место снижение андрогенсекретирующей функции яичников, проявляющаяся в аномально низких значениях общего тестостерона (менее 1 нмоль/л). По наблюдению этих авторов, гипоандрогенное состояние является самостоятельным фактором риска «бедного ответа», которое не коррелирует с уменьшением овариального резерва. Таким пациенткам эти авторы рекомендуют назначать тестостерон-содержащий препарат Андрогель (в суточной дозе 2.5 г геля, содержащего 25 мг тестостерона) в течение 15–20 дней до начала стимуляции гонадотропинами, что позволяет снизить частоту «бедного ответа». Механизм положительного эффекта «андрогенного прайминга» у таких пациенток авторы связывают со способностью андрогенов активизировать ранний рекрутинг фолликулов в созревающую когорту, увеличить экспрессию рецепторов к ФСГ на клетках гранулезы малых антральных фолликулов и поддерживать адекватную чувствительность ФСГ-рецепторов на всех гормонально-зависимых этапах фолликулогенеза.
Авторы, предложившие методику эстрогенного прайминга (эстрогены в лютеиновую фазу предыдущего цикла), исходили из того, что когорта фолликулов, которая вступит в активный фолликулогенез в следующем менструальном цикле, формируется в середине лютеиновой фазы предыдущего. Назначение эстрогенов в этот период, по мнению разработчиков данной методики, может пролонгировать стимулирующий эффект ФСГ в лютеиновой фазе цикла, а также увеличивать уровень продукции эстрогенов растущими фолликулами, обеспечивая их более быстрый рост.
Сообщений о возможном влиянии гормонов роста (СТГ) на функцию яичников чрезвычайно мало. Существуют единичные публикации ряда авторов (Аншина М. Б., 1998; Kucuk T. et al., 2008; Kolibianakis E. M. et al., 2009).
Смысл назначения оральных контрацептивов в монофазном режиме заключается во временном торможении гипоталамо-гипофизарно-яичниковой системы, после чего в последующем цикле вероятен так называемый ребаунд-эффект, т. е. активация деятельности этой системы. Представленная методика зачастую оказывается эффективной у пациенток молодого возраста, у которых наблюдается олигоменорея и ановуляция на фоне достаточной или же высокой концентрации эстрогенов. В то же время назначение оральных контрацептивов женщинам со сниженными показателями овариального резерва и сопутствующей гипоэстрогенией вряд ли является перспективным методом надежного предупреждения «бедного ответа».
Назначение гормонов в циклическом режиме (заместительная гормонотерапия) — эстрогены в возрастающей дозе в фолликулярную фазу, препараты прогестерона совместно с эстрогенами в лютеиновую фазу — имитирует физиологические колебания уровней половых стероидов в течение менструального цикла. Возможно, это полезно в обеспечении трансформации эндометрия, но вряд ли может положительно сказаться на последующем ответе яичников на стимуляцию их функции.
Гестагены как предварительное лечение, скорее всего, не имеют отношения к последующей способности яичников отвечать на стимуляцию гонадотропинами. Показаниями для назначений этих препаратов являются наличие фолликулярных кист в яичниках, необходимость фиксации менструальноподобной реакции и обеспечение адекватной трансформации эндометрия.
Неспецифические средства — биологически активные добавки, фитоэстрогены, гомеопатические препараты — в настоящее время довольно широко используют не только врачи, но и пациенты, занимающиеся самолечением. При «бедном ответе» яичников и/или многочисленных неудачных попытках ЭКО — это «средства отчаяния».
Приходится признать, что на сегодняшний день результаты различных метаанализов так и не подтвердили достоверной эффективности каких-либо определенных лекарственных препаратов [10].
Другими возможными путями решения результативности программ у пациенток старшей возрастной группы с прогнозом бедного ответа может стать использование комплексных программ ЭКО с параллельным использованием донорских ооцитов (нативных или витрифицированных) или донорских эмбрионов. Проведение таких программ ЭКО, выполняемых за счет средств ТФ ОМС, возможно с параллельным использованием в этой программе донорских ооцитов (нативных или витрифицированных) или донорских эмбрионов за счет средств самой пациентки после подписания супружеской парой всех необходимых юридических документов. При этом на этапе переноса эмбрионов всегда переносится не менее двух эмбрионов. Один эмбрион, полученный путем оплодотворения спермой мужа ооцитов пациентки (обычно низкого качества), другой — либо полученный путем оплодотворения донорских ооцитов спермой мужа (обычно хорошего качества), либо донорский эмбрион. При отсутствии эмбрионов, полученных от оплодотворения спермой мужа ооцитов пациентки, осуществляется перенос двух эмбрионов, полученных путем оплодотворения донорских ооцитов спермой мужа или двух донорских эмбриона.
Целью данного исследования было дать сравнительную характеристику эффективности базовых программам ЭКО и ПЭ, проводимых в условиях государственной поддержки за счет средств ТФ ОМС и комплексных программ с сочетанным финансированием (наряду со средствами ТФ ОМС параллельная оплата ДО, ДЭ или донорской программы из собственных средств) у пациенток старшего репродуктивного возраста с низким овариальным резервом и прогнозом бедного ответа.
Материалы и методы исследования
Нами были проанализированы исходы программ, выполняемые за счет средств ТФ ОМС на базе отделения вспомогательных репродуктивных технологий МОПЦ за 2015 и 2021 гг. у пациенток старшего репродуктивного возраста с прогнозом «бедного ответа», которые были разделены на две группы. 1-ю группу составили 69 пациенток, которым была проведена базовая программа ЭКО и ПЭ в 2015 г., во 2-ю группу вошло 60 пациенток с проведенной как базовой, так и комплексной программой ЭКО и ПЭ в 2021 г. Также была выделена 2а подгруппа — 26 пациенток из 60, которым была проведена комплексная программа ЭКО и ПЭ. Все супружеские пары были обследованы по единому стандарту (Приказ № 107н МЗ РФ), а в период проведения программы — согласно Приказу № 556 от 30.10.12.
Отбор пациентов для программ вспомогательных репродуктивных технологий за счет средств ТФ ОМС проводился по критериям, рекомендованным и изложенным в Информационно-методическом письме МЗ РФ и Федерального Фонда ОМС № 15–4/10/2–1777 и № 1359/30–4 от 18.03.2014 г. «О направлении граждан Российской Федерации для проведения процедуры ЭКО в 2014», а также в соответствии с Приказом МЗ РФ № 916н от 10.12.13 «О перечне видов высокотехнологичной помощи». Критериями отбора пациенток для ведения комплексных программ с параллельным использованием донорских ооцитов являлось снижение овариального резерва, определяемое Болонскими критериями ESHRE. Основной регламентирующей документацией, дающей возможность проводить комплексные программы, послужили Приказ МЗ РФ № 107н от 30.08.2012, Приказ МЗ РФ № 556 от 30.10.12, информационно-методическое письмо МЗ РФ от 29.03.2016. В Приказе № 107н от 30.08.2012 «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению», п. 22а: «Ограничениями для применения базовой программы ЭКО является снижение овариального резерва (по данным УЗИ и уровня АМГ в крови)»; в п. 22б о. Приказом № 556 от 30.10.12 г. «Об утверждении стандарта медицинской помощи при бесплодии с использованием вспомогательных репродуктивных технологий» обозначены процедуры и лекарственные препараты базовой программы ЭКО, оплачиваемые из средств ТФ ОМС. Информационно-методическое письмо МЗ РФ и ФОМС от 22 марта 2021 г. «О направлении граждан Российской Федерации для проведения процедуры ЭКО» указывает на возможность в рамках базовой программы ЭКО, финансируемой за счет ТФ ОМС, использовать дополнительные медицинские услуги, оплата которых производится за счет иных средств. «Оплата медицинских услуг при проведении процедуры ЭКО в рамках базовой программы ОМС, не предусмотренных стандартом медицинской помощи при бесплодии с использованием вспомогательных репродуктивных технологий … (использование донорских ооцитов, донорской спермы, донорской спермы, донорских эмбрионов, суррогатное материнство, криоконсервация и хранение своих половых клеток, тканей репродуктивных органов и эмбрионов) производится дополнительно за счет личных средств и иных средств, предусмотренных законодательством РФ».
Стимуляция суперовуляции проводилась по длинному протоколу с мини-дозами АГ-РГ (Диферелин дейли форма по 0,1 мг вводили 0,05–0,025 мг). Выбор препарата определялся его безопасностью, эффективностью и простыми условиями хранения). Стимуляция яичников осуществлялась рекомбинантным фолликулостимулирующим гормоном человека Гонал-Ф. Выбор препарата определялся его качеством, эффективностью и разнообразием удобных форм и доз введения (флаконы по 75 МЕ, шприц-ручки по 300 МЕ с уменьшающейся минимальной дозировкой и шагом введения препарата). Наряду с рекомбинантным фолликулостимулирующим гормоном с целью оптимизации дозревания фолликулов применялись мочевые гонадотропины (Менопур). Суточная доза ГТ — 300 МЕ. В качестве триггера овуляции использовался рХГЧ — Овитрель 250 мкг. Поддержка лютеиновой фазы проводилась микронизированным прогестероном (Утрожестан). Подготовка эндометрия в программах осуществлялась трансдермальными формами эстрогенов. Критериями назначения препаратов эстрогенов являлись толщина эндометрия по УЗИ и гормональный профиль. Выбор препарата определялся удобством введения.
Результаты исследования
Все пациентки до программы были обследованы согласно Приказу МЗ РФ № 107н от 30.08.2012, а в период проведения программы — согласно Приказу № 556 от 30.10.12. По основным показателям овариального резерва, среднего возраста, анамнестическим данным группы были сопоставимы. Средний возраст пациенток первой группы составил 39,8 года, второй группы — 40,1 года (рис. 2). Показатели овариального резерва в первой группе составили: уровень ФСГ — 11,2 МЕ/л, АМГ — 0,3 нг/мл, количество антральных фолликулов, определяемых по УЗИ, — 4,8. Во второй группе эти показатели: ФСГ — 10,8 МЕ/л, АМГ — 0,32 нг/мл, количество антральных фолликулов — 5,1 (рис. 3).
У пациенток 1-й и 2-й групп женское бесплодие сочеталось с мужским фактором — астенотератозооспермией в различных сочетаниях умеренной степени выраженности в 42%.
Культивирование эмбрионов проводилось до 5 суток, оценка их качества проводилось по шкале Гарднера. Количество получаемых ооцитов/из них зрелых на одну пациентку составило (р < 0,05): в 1-й группе 3,7 ± 1,1/2,7 ± 1,8, в 2-й группе — 4,7 ± 2,2/4,1 ± 1,2, во 2а группе — 7,7 ± 3,4/5,7 ± 2.4.
Количество полученных эмбрионов на одну пациентку/из них эмбрионов высшего качества (р < 0,05): в 1-й группе — 2,1 ± 1,1/1,1 ± 0,4, в 2-й группе — 2,9 ± 1,4/1,8 ± 0,8; во 2 а группе — 4,4 ± 1,8/2,7 ± 1,2. У всех пациенток перенос эмбрионов проводился на 5-е сутки культивирования.
При проведении комплексных программ осуществлялся перенос двух эмбрионов. Один эмбрион, полученный путем оплодотворения ооцитов пациентки спермой мужа (среднего или низкого качества), второй — донорский, полученный путем оплодотворения донорских ооцитов спермой мужа (высокого качества). В программах с использованием донорских эмбрионов переносились эмбрионы высокого качества. При отсутствии «собственных» эмбрионов проводился перенос двух донорских эмбрионов либо эмбрионов, полученных путем оплодотворения донорских ооцитов спермой мужа. Эффективность программы ЭКО (частота наступления беременности) составила: в 1-й группе — 11,6% на цикл; во 2-й группе — 21,6% на цикл (13), во 2а группе — 38,4% на цикл (10) (рис. 4).
Выводы
Проведена сравнительная характеристика эффективности базовых программам ЭКО и ПЭ, проводимых в условиях государственной поддержки за счет средств ТФ ОМС и комплексных программ с сочетанным финансированием (наряду со средствами ТФ ОМС параллельная оплата ДО, ДЭ или донорской программы из собственных средств) у пациенток старшего репродуктивного возраста с низким овариальным резервом и прогнозом бедного ответа. В целом за отчетный период результативность программ, выполненных в 2021 г., составила 11,6%, а в 2021 г. — 21.6%, то есть увеличилась на 10%. Причем результативность только комплексных программ сопоставима с результативностью программ у пациенток до 35 лет и равна 38,4%. Это говорит о том, что возраст — важный фактор эффективности программ ЭКО и ПЭ, определяющий количество полученных при стимуляции суперовуляции ооцитов, качество переносимых эмбрионов, частоту наступления индуцированной беременности. Применение комплексных программ ЭКО и ПЭ при государственной поддержке у пациенток старше 38 лет значительно улучшает их результативность, а также позволяет пациенткам попытаться использовать полностью свой овариальный резерв. В ряде случаев донорские эмбрионы и эмбрионы, полученные путем оплодотворения донорских ооцитов спермой мужа, способствуют имплантации собственных эмбрионов невысокого качества. Полученные данные требуют дальнейшего исследования и анализа.
Литература
- Российская ассоциация репродукции человека, Регистр ВРТ, отчет за 2014.
- Боярский К. Ю. Факторы, определяющие овариальный резерв // Акуш. и жен. беспл. 2009, 2: 65–69.
- Назаренко Т. А., Мишиева Н. Г. Бесплодие и возраст. М.: МЕДпресс-информ, 2014. С. 7–22.
- ЕSHRE consensus on the definition of ‘poor response’ to ovarian stimulation for in vitro fertilization: the Bologna criteria // Hum. Reprod. 2011, 26 (7): 1616–1624. DOI: 0.1093/humrep/der092 First published online: April 19, 2011).
- Рудакова Е. Б., Замаховская Л. Ю., Стрижова Т. В. и другие. Исходы экстракорпорального оплодотворения как мультифакторная проблема клинической репродуктологии // Медицинский совет. 2015, 9: 46–54.
- Назаренко Т. А., Краснопольская К. В. Бедный ответ. М.: МЕДпресс-информ, 2013. С. 40.
- Назаренко Т. А. Стимуляция функции яичников. М.: МЕДпресс-информ, 2013. С. 82–83.
- Назаренко Т. А., Краснопольская К. В. Бедный ответ, М.: МЕДпресс-информ, 2013. С. 45–51.
- Краснопольская К. В. Клинические аспекты лечения бесплодия в браке. М.: ГЭОТАР-Медиа, 2014. С. 240.
- Назаренко Т. А., Краснопольская К. В. Бедный ответ. М.: МЕДпресс-информ, 2013. С. 4–44.
Е. Б. Рудакова1, доктор медицинских наук, профессор Е. А. Федорова И. В. Сергеева
ГБУЗ МО МОПЦ, Балашиха
1 Контактная информация
Возможности улучшения результативности ЭКО и ПЭ у пациенток старшего репродуктивного возраста/ Е. Б. Рудакова, Е. А. Федорова, И. В. Сергеева
Для цитирования: Лечащий врач №12/2017; Номера страниц в выпуске: 11-16
Теги: бесплодие, беременность, поздний репродуктивный возраст
Стимуляция суперовуляции
Чтобы вероятность наступления беременности после одной попытки ЭКО, после подсадки эмбрионов была выше, необходимо получить несколько пригодных для оплодотворения яйцеклеток. С этой целью перед процедурой проводится так называемая стимуляция суперовуляции, когда женщине назначают лекарственные средства, вызывающие одновременное созревание нескольких фолликулов. Для стимуляции суперовуляции могут применяться различные препараты. Перед началом стимуляции врач вместе с вами обсуждает наиболее подходящий вариант лечения, выбирает препараты, определяется с последовательностью их применения, которая называется «протоколом стимуляции».
Препараты для стимуляции суперовуляции
Препараты, содержащие фолликулостимулирующий гормон За созревание фолликулов отвечает фолликулостимулирующий гормон (ФСГ), поэтому при стимуляции суперовуляции применяются препараты, содержащие ФСГ. Наиболее эффективными сейчас считаются рекомбинантные препараты. Они повышают частоту наступления беременности, уменьшают затраты на лечение. Одним из таких рекомбинантных ФСГ является препарат Пурегон, созданный путем генной инженерии. Сейчас для максимального удобства женщин используется ручка-инжектор Пурегон Пэн. Ручка-инжектор Пурегон Пэн предназначена для самостоятельного подкожного введения Пурегона пациентками. Ручка предусмотрена для многоразового использования при помощи картриджа с уже готовым раствором Пурегона.
Пурегон-Пэн уменьшает болезненность манипуляции благодаря микроигле– это новый метод введения ФСГ – Пурегона, который обеспечивает следующие преимущества:
- максимальную точность введения назначенной доктором дозы Пурегона,
- максимальные возможности коррекции дозы с индивидуальными особенностями пациентки,
- максимальное удобство при использовании,
- уменьшают дополнительный стресс, связанный с самим процессом лечения, соответственно у Вас возрастает уверенность.
Препараты, подавляющие выработку собственных гормонов гипофиза (агонисты, антагонисты гормонов) Чтобы собственные гормоны гипофиза женщины не мешали стимуляции суперовуляции, их выработка блокируется антагонистами. Оргалутран – это новый антагонист, позволяющий мгновенно блокировать гипофиз, а затем быстро восстанавливать его работу, что почти на половину сокращает длительность лечения, по сравнению с традиционными средствами (агонистами). Агонисты (трипторелин, гозерелин, лейпрорелин, бусерелин) требуют достаточно длительного введения. Их нужно вводить ежедневно на протяжении 20–30 дней, или однократно, но большую дозу, рассасывающуюся около месяца.
Препараты, содержащие хорионический гонадотропин (ХГЧ) Пункция фолликулов проводится через 36 часов после инъекции ХГЧ, который инициирует овуляцию созревших фолликулов. Использование ХГЧ позволяет получить созревшую яйцеклетку, готовую к оплодотворению. Одним из препаратов, содержащих ХГЧ, является Прегнил.
Возможные негативные последствия
При всей своей эффективности ЭКО и стимуляция яичников, как один из этапов экстракорпорального оплодотворения, может иметь негативные последствия.
Учитывая, что для стимуляции используются гормональные медицинские препараты, у женщины могут развиться следующие негативные факторы:
- Избыточный вес и ожирение
- Вздутие живота, боли в животе, диарея и тошнота
- Болезненность и увеличение молочных желез
- Скопление жидкости в грудной клетке и животе
- Образование кист в яичниках
Все эти факторы можно отнести к проявлению синдрома гиперстимуляции яичников (СГЯ), без которой невозможно получить несколько, готовых к оплодотворению яйцеклеток. Женщине перед прохождением процедуры необходимо понимать, что практически любое вмешательство в гормональный метаболизм организма бесследно не проходит и может быть чревато серьезными последствиями.
СГЯ начинает развиваться тогда, когда активность яичников становится слишком выраженной, что наносит вред практически всем внутренним системам и органам.
В первую очередь гиперстимуляция затрагивает сами яичники: они увеличиваются в размерах, появляется отечность. Во время проведения лабораторного анализа крови можно заметить признаки ее сгущения. По этой причине почкам становится тяжело выводить из организма скопившуюся жидкость, которая начинает накапливаться в различных полостях организма. Происходит сбой в работе всей мочевыделительной системы, нарушается работа органов желудочно-кишечного тракта и органов дыхания.
Для того, чтобы снизить гиперстимуляцию яичников, врачи чаще всего используют амбулаторное лечение, которое подразумевает прием медицинских препаратов для разжижения крови, специальную диету, большое потребление жидкости и покой.
Протоколы стимуляции суперовуляции
При экстракорпоральном оплодотворении применяются разные виды протоколов. Следует помнить, что жестких схем лечения нет, для каждого из приведенных ниже протоколов возможны индивидуальные вариации.
«Чистый протокол»
У некоторых женщин применяются схемы стимуляции без блокады гипофиза. Для этого используются только препараты, содержащие ФСГ, например Пурегон Пэн. Такая схема называется «чистой». Ее недостатком является вероятность преждевременной овуляции (разрыва) фолликула еще до пункции, что делает невозможным получение яйцеклеток. При этом протоколе введение стимулирующих препаратов начинается со 2–3 дня менструации, а продолжается 9–14 дней. Ежедневная доза корректируется врачом в зависимости от данных УЗИ, которое выполняется обычно 4–5 раз за весь период стимуляции. Для окончательного созревания фолликулов вводится ХГЧ, например Прегнил, через 35–36 часов производится пункция фолликулов.
«Длинный протокол»
Протокол называется «длинным», потому что, как правило, он начинается с 21–23-го (редко со 2–3-го) дня менструального цикла, предшествующего стимуляции. Чтобы заблокировать гипофиз, первые 5 дней от начала лечения, принимается только агонист. После достижения блокады гипофиза наступает менструация, а со второго — третьего дня от ее начала проводится стимуляция препаратами, содержащими ФСГ, так же, как при «чистой» схеме, но совместно с продолжающимся введением агониста.
«Оптимальный протокол»
При использовании нового антагониста Оргалутрана протокол стимуляции значительно укорачивается, хотя сохраняется выраженная легко обратимая блокады гипофиза. Стимуляция начинается, как при «чистой» схеме, со 2–3 дня менструального цикла путем ежедневного введения препарата, содержащего ФСГ. Затем с 5-го или 6-го дня стимуляции делаются ежедневные инъекции Оргалутрана, однако стимуляция продолжается. Таким образом, «Оптимальный протокол» становится коротким, соответственно эффективным. Комбинация препарата нового покаления Пурегона с Оргалутраном (антагонист) — это: — сокращение сроков лечения; — лучшая переносимость инъекций; — доказанная эффективность. Благодаря этому совместное использование Пурегона с Оргалутраном можно назвать – « Два слагаемых надежды при лечении бесплодия».
Лечение в Репродуктивном
Репродуктологи к каждому случаю подходят индивидуально. Чтобы подобрать наиболее подходящую схему стимуляции, на первом этапе проводится детальное обследование женщины. В первую очередь оценивается овариальный резерв и составляется прогноз ответа яичников на стимуляцию. В зависимости от этого выбирается конкретный протокол, препарат и его стартовая доза. Одновременно с этим проводится профилактика возможных осложнений. Для того чтобы создать лучшие условия для развития беременности, подсаживается оптимальное количество эмбрионов. При наличии генетических заболеваний у пары проводится предимплантационная диагностика. Все это позволяет нам проводить лечение максимально эффективно и безопасно.
Самые передовые достижения в области репродуктивной медицины внедрены и успешно применяются в «СМ-Клиника». Позаботьтесь о своем будущем и будущем своих детей сейчас – записывайтесь на консультацию к опытным репродуктологам!
Делаем инъекции сами
Перед тем, как приступить к инъекциям, внимательно ознакомьтесь с условиями хранения препаратов. Одни из них требуют хранения при температуре, близкой к 0°С. Другие могут храниться при комнатной температуре. Пурегон Пэн, Оргалутран, Прегнил хранятся при температуре от 3°С до 25–30°С. Замерзание препаратов, также как прямой солнечный свет могут изменить их активность.
Как делать инъекции?
При помощи ручки-инжектора Пурегон Пэн пациентки делают себе инъекции сами, без дополнительной помощи со стороны медицинского персонала. Это просто , а главное, удобно. Если женщина использует препараты, которые вводятся при помощи шприца, можно обратиться за помощью или в процедурный кабинет клиники, или в поликлинику по месту жительства, или привлечь знакомых с навыками проведения инъекций. Пурегон или Оргалутран вводятся подкожно, Прегнил – внутримышечно. Инъекции нужно делать в одно время, например, во второй половине дня, обстановка при этом должна быть максимально спокойной. Препараты нужно вводить медленно. Каждая введенная доза имеет большое значение, поэтому ошибки при введении могут существенно сказаться на результате всего лечения. Если вы забыли ввести препарат, не вводите его двойную дозу для того, чтобы восполнить пропущенную инъекцию, а сразу же проконсультируйтесь с лечащим врачом. Некоторые препараты, например Прегнил, выпускаются порошковыми, к ним отдельно прилагаются ампулы растворителя.. Внимательно ознакомьтесь с инструкцией. Растворять препараты можно только при помощью стерильного шприца. Вещество растворяется мгновенно, без посторонних примесей.
Мониторинг
Во время стимуляции суперовуляции проводится ультразвуковой мониторинг роста фолликулов яичника, а также созревания эндометрия. Это нужно для корректировки дозы вводимых препаратов, которая может быть увеличена или уменьшена. Все зависит от состояния данных органов. С одной стороны, необходимо получить достаточное количество зрелых яйцеклеток, но с другой стороны, избыточная стимуляция может привести к осложнениям. Зрелым считается фолликул, диаметром 17–20 мм, при толщине слизистой оболочки матки (эндометрия) больше 8 мм.
УЗ-мониторинг
Мониторинг проводится вашим лечащим врачом, как правило, на 2–3-й день менструального цикла. Тогда же назначаются стимулирующие препараты. Следующее исследование роста фолликулов повторяется приблизительно через 5 дней. Дальнейшие исследования проводятся чаще, почти ежедневно до достижения фолликулами размеров, близких к овуляторным. Исследование проводится ультразвуковым датчиком, который вводится во влагалище. Процедура эта безболезненная. Проводить ее безопасно. Для обеспечения стерильности на датчик надевается одноразовый презерватив. Оценивается толщина эндометрия, а также количество, диаметр фолликулов, при этом врач решает вопрос об изменении дозы препаратов. При достижении определенных критериев, обычно на 10–14-й день цикла принимается решение об окончании стимуляции. После этого происходит назначение препаратов чХГ, сообщается точное время их введения, а также дата предстоящей пункции.
Что делать Вам?
Если вам назначен день УЗ-мониторинга, утром нельзя делать никаких инъекций без рекомендаций врача. УЗИ через влагалище проводится при опорожненном мочевом пузыре, иначе врачу нельзя будет увидеть на мониторе яичники. Вам придется раздеться, как для гинекологического осмотра.
Введение чХГ
Препараты чХГ (Прегнил) вводятся для окончательного созревания яйцеклетки. Врач сообщит вам точное время введения препарата, которое обычно приходится на вечерние часы. Очень важно точно соблюдать время введения препарата. Путь введения – внутримышечный. Правила введения те же, что были описаны ранее для внутримышечных средств. Внимательно проверьте дозу препарата, так как ампула может быть 1 500, 5 000 МЕ (Международных Единиц). Половые контакты следует прекратить. Очень важно не опоздать, прибыть на пункцию вовремя, через 35–36 часов после инъекции чХГ. С собой на пункцию желательно взять халат, тапочки, ночную сорочку или длинную футболку, захватите носки. Когда Вам будут делать пункцию, понадобится присутствие супруга.
Сколько дней длится стимуляция при ЭКО
Временной промежуток определяется врачом, исходя из состояния здоровья женщины. Поэтому стимуляция овуляции при ЭКО длится у каждой пациентки по-разному.
Так, короткий протокол, длительностью один месяц, предусматривает стимуляцию яичников в течение 10 суток. А женщинам, у которых выявлены эндометриоз, кистообразные изменения на яичниках, миома, показано гормональное лечение в течение 30-40 дней, что предусматривает использование длинного протокола. В некоторых случаях показана супердлинная стимуляция яичников, длительность которой может доходить до полугода.
Длительность протокола и интенсивность приема гормональных средств напрямую зависит от состояния здоровья, возраста и репродуктивных особенностей женщины.
При стимуляции могут появиться обильные прозрачные выделения. Пугаться этого не нужно: обычно это свидетельствует о хорошем росте эндометрия. Насторожиться стоит, если есть зуд, боль, резкий неприятный запах, если цвет выделений зеленоватый. Все эти симптомы могут говорить о воспалении, которое вам сейчас совсем некстати.
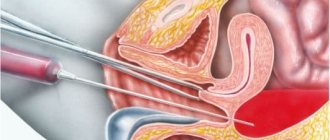
Пункция
Пункция фолликулов яичника проводится с целью получения яйцеклеток. Во время пункции врач под контролем ультразвука опорожняет фолликулы через влагалище с помощью иглы, подсоединенной к вакуумному прибору. Как правило, пункция производится утром, строго натощак, под внутривенным наркозом. Бояться нет причин, эта процедура безболезненная, быстрая, никаких серьезных повреждений тонкая игла не нанесет.
До пункции
Накануне нельзя ничего есть, даже пить после полуночи. Можно побрить волосы вокруг входа во влагалище. Нельзя пользоваться декоративной косметикой. Непосредственно перед пункцией, уже в клинике ЭКО, вам нужно, опорожнив мочевой пузырь, надеть чистую сорочку. Если у вас есть аллергия к каким-либо лекарственным препаратам, обязательно предупредите об этом анестезиолога.
После пункции
Через 5–10 минут вы проснетесь, а через 40–60 минут после пункции сможете встать. Врач расскажет о результатах пункции, о том, сколько было получено яйцеклеток, а затем определит дату следующего визита для переноса эмбрионов. Следующая процедура – имплантация эмбриона, на какой день ее назначить, вам скажет врач. Врач также распишет вам назначения на ближайшие две недели, направленные на поддержание достаточного уровня гормонов беременности после подсадки эмбрионов(инъекции чХГ или препараты прогестерона). Лучше, чтобы кто-нибудь сопровождал вас после пункции. После пункции категорически запрещается находиться за рулем. Если Вы почувствовали боль низа живота, можно принять таблетку болеутоляющего препарата после консультации с лечащим врачом. О качестве яйцеклеток, спермы, удачности оплодотво- рения, дроблении, количестве эмбрионов вы можете получить информацию только у лечащего врача.
Фолликулостимулирующий гормон: норма и значение
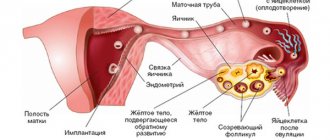
ФСГ вырабатывается гипофизом, а его поступление в кровь имеет импульсный режим. На протяжении суток периодически выбрасываются большие количества. Они выше нормы примерно в 1,5-2 раза. Основная роль фоллитропина – это подготовка фолликула к овуляции. После нее ФСГ помогает образованию прогестерона.
Для ЭКО показатели уровня гормона нужны для:
- определения дозы препаратов, которые содержат его синтетические аналоги;
- выбора протокола (длинный или короткий);
- оценки риска гиперстимуляции.
Для первой фазы цикла норма ФСГ – 1,37-9,91 мМЕ/мл.
Искусственное оплодотворение
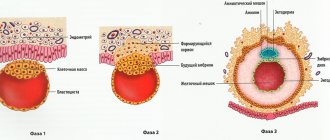
Когда наступит день пункции, супруг должен сдать сперму лаборанту. Сперму очищают от лишней плазмы, готовят для оплодотворения, проверяя количество, качество, а также подвижность сперматозоидов. Полученную после пункции яичников фолликулярную жидкость, наполненную яйцеклетками, изучают под микроскопом, находят яйцеклетки, отбирают их и отмывают. Каждую яйцеклетку бережно кладут в отдельную луночку специальной чашки, наполненной питательной средой. Чашки со сперматозоидами всегда сразу же подписывают. Затем, если сперматозоидов достаточное количество и они подвижны, часть спермы добавляют к яйцеклеткам, после чего оставляют инкубатор приблизительно на 12 часов. Сперматозоиды сами должны подплыть к яйцеклеткам и оплодотворить их. Затем проверяют, произошло ли оплодотворение. Оплодотворенные яйцеклетки, а точнее, уже эмбрионы, продолжают культивировать от 2 до 5 дней.
ИКСИ
Если сперматозоидов слишком мало, то производится процедура ИКСИ, то есть введение единичного сперматозоида при помощи микроиглы. Под контролем микроскопа, используя микроманипуляторы, эмбриолог отбирает только качественные сперматозоиды и вводит их вовнутрь яйцеклетки.
Перенос эмбрионов
Когда будет проводиться имплантация эмбриона, на какой день назначить процедуру переноса эмбрионов — определяет врач. Как правило, это происходит через 2–5 дней после пункции. Эмбрионы могут переносить как при стадии нескольких клеток – бластомеров, так и при более поздней стадии – бластоцисты. Процедура подсадки эмбриона безболезненная, хотя иногда возможен легкий дискомфорт. Вовнутрь влагалища вводятся гинекологические зеркала, а в канал шейки матки вводится гибкий катетер. По этому катетеру переносятся эмбрионы, число которых определяет врач. Обычно рекомендуется переносить два эмбриона, поскольку подсадка большего числа нежелательна из-за опасности развития многоплодной беременности. После подсадки эмбрионов оставшиеся качественные эмбрионы можно подвергнуть замораживанию для того чтобы была возможность использовать их при следующих попытках.
Что вам делать при переносе эмбрионов?
Во время введения катетера постарайтесь максимально расслабиться, не напрягая низ живота. Постарайтесь положительно настроиться. После переноса эмбрионов некоторое время можно находиться горизонтально. Возвращаться домой лучше с сопровождением. Дома также следует расслабиться, постараться отвлечься от навязчивых тревог.
Что делать дальше?
На этом этапе — после подсадки эмбрионов — программа заканчивается. Если осложнений нет, эмбрион в матке закрепился и успешно развивается, то Вас не госпитализируют. Но при желании после подсадки эмбрионов вы можете обратиться с просьбой о стационаре. Врач дает четкие рекомендации о дальнейшем поддерживающем гормональном лечении, которые необходимо строго выполнять. Возможно, вам будут назначены препараты для гормональной поддержки беременности – прогестерон или ХГ. Старайтесь щадить себя физически и психологически первые недели после переноса эмбрионов. Старайтесь больше пить. После подсадки эмбрионов желательно измерять массу тела, следить за мочеиспусканием, объемом живота, частотой пульса. Если вас что-то беспокоит, сразу же свяжитесь с клиникой. Там вам будет выдан больничный лист сроком 10–14 дней. Если после подсадки эмбрионов наступит беременность, больничные листы может выдавать женская консультация по месту жительства.
Беременность – да или нет?
Наступила беременность или нет, можно будет узнать не ранее 14-го дня после переноса эмбрионов. Не пытайтесь до этого момента самостоятельно определить беременность с помощью тестов, поскольку на этих сроках эмбрион еще не может продуцировать достаточные количества гормона ХГ. Ответ также может быть неправильным из-за приема некоторых гормональных препаратов. Кроме того, экспресс-полоски тестов часто дают ложные результаты. Через две недели после переноса эмбрионов обратитесь для исследования крови на бета-субъединицу ХГ, который является индикатором беременности. Если результат исследования положительный, – значит, беременность наступила. Почти каждые полтора — два дня количество ХГ будет удваиваться. Беременность после подсадки эмбрионов, определенная по ХГ, называется «биохимической беременностью». Ей еще нужно подтверждение УЗИ, которое позволяет увидеть плодное яйцо, только начиная с 3-й недели после переноса эмбриона. Поэтому после подсадки эмбрионов вам нужно будет прийти для УЗИ- диагностики беременности. Если наступила беременность, вы должны находиться под постоянным наблюдением акушеров-гинекологов, так как вам еще предстоит после подсадки эмбрионов выносить беременность, доставшуюся таким нелегким путем. При появлении болей, кровянистых выделений и других тревожных симптомов незамедлительно обращайтесь к своему лечащему врачу. Появление менструации, отрицательный результат теста, отсутствие плодного яйца по данным УЗИ говорит о том, что после подсадки эмбрионов беременность не наступила. Однако отрицательный результат еще не означает, что метод ЭКО оказался неэффективным. Последующие попытки могут стать удачными. Как уже говорилось, вероятность наступления беременности после подсадки эмбрионов на одну попытку составляет от 20 до 30% и с каждой последующей попыткой суммарные шансы забеременеть возрастают за год лечения до 90 %. Между попытками можно сделать интервал около 2 месяцев. Если вы не сможете посетить центр для диагностики беременности, то определение ХГ в крови после подсадки эмбрионов и УЗИ можно провести в клиниках по месту жительства. Но в любом случае, пожалуйста, сообщите вашему лечащему врачу в центре ЭКО о результатах диагностики и обсудите дальнейшие действия.
Как подготовиться
Анализы перед ЭКО нужно сдавать и женщине, и мужчине (если в протоколе будет использоваться донорская сперма, тогда только женщине). Пациентке назначают анализы мочи, крови (на группу и резус, общий, биохимия, коагулограмма, ТОРЧ-инфекции, гормоны щитовидной железы и половые), гинекологические мазки, бакпосев, кольпоскопию, УЗИ щитовидной и молочных желез, органов малого таза, по показаниям врач может направить на гистероскопию, лапароскопию. Нужно иметь на руках флюорограмму, ЭКГ, заключение терапевта о допуске к процедуре.
За месяц или два перед вступлением в протокол может быть назначен прием гормональных препаратов. Это позволит яичникам отдохнуть перед стимуляцией и дать хороший ответ на препараты. Рекомендована диета: больше белковых продуктов и чистой воды, меньше фастфуда, бобовых, хлеба (чтобы исключить газообразование). Важен отказ от сигарет и алкоголя, вредные привычки негативно сказываются на качестве и количестве ооцитов.
Пациент сдает менее обширный список анализов для ЭКО: общий крови, мочи, биохимию, ТОРЧ-инфекции. Также нужны результаты урологических мазков, и самое главное — спермограмма (по показаниям MAR-тест). За пару месяцев до протокола рекомендовано отказаться от курения, алкоголя, посещения сауны и бани, ношения тесного белья и использования подогрева сиденья в автомобиле. Всё это может может значительно ухудшить качество спермы.
Возможные осложнения
Гиперстимуляция яичников
В результате стимуляции яичников после пункции на месте фолликулов образуется много так называемых желтых тел. Некоторые женщины плохо переносят избыток гормонов, вырабатываемых желтым телом. Приблизительно в 10% случаев развивается легкая форма синдрома гиперстимуляции. На это указывают боли в низу живота, тошнота, увеличение живота. В более серьезных случаях наблюдается слабость, уменьшение количества мочи, сильное вздутие живота. При редких тяжелых формах может затрудняться дыхание и снижаться артериальное давление. Лечение синдрома гиперстимуляции обычно заключается в обильном питье и приеме специальных препаратов, которые иногда могут вводиться внутривенно капельно. При легких формах гиперстимуляции можно оставаться дома, но обязательно следует держать врача в курсе вашего состояния. Более тяжелое течение заболевания требует госпитализации.
Многоплодие
Чтобы повысить вероятность наступления беременности с помощью метода ЭКО, в матку женщины, как правило, переносится несколько эмбрионов (не более трех). Иногда после подсадки эмбрионов это может привести к развитию многоплодной беременности. Если плодов в матке развивается больше двух, то выносить такую беременность бывает достаточно сложно. Существуют методы, позволяющие прекратить развитие одного эмбриона, не затрагивая другие. Эта операция называется редукцией плода и проводится под контролем ультразвука. Обычно после подсадки эмбрионов оставляют два эмбриона. Вероятность благополучно выносить беременность после редукции эмбрионов выше, чем если оставить тройню.
Внематочная беременность
Если после переноса эмбрионов появятся слабость, головокружение, ранние признаки беременности, неопределенные или резкие боли , то, возможно, это внематочная беременность, при которой плод развивается не в матке, а за ее пределами. Немедленно обратитесь к врачу, поскольку данное состояние представляет угрозу для жизни, так как разрыв трубы может вызвать сильное кровотечение. Внематочная беременность обычно устраняется путем щадящей лапароскопической операции. Если Вы почувствуете возникновение любых, из перечисленных выше симптомов, немедленно обратитесь к лечащему врачу. Запишите телефон клиники, а также имя доктора. Узнайте также телефоны для экстренной связи. Соблюдая все рекомендации врача, вы снизите риск осложнений, одновременно шансы на счастливое зачатие.
Старые методы поддержки прогестероном после переноса эмбрионов
Поддерживающая терапия в недавнем прошлом была довольно агрессивной несмотря на то, что длительный период времени первые ЭКО проводились без всякой гормональной поддержки.
Поскольку при ЭКО забирают фолликулы, развитие желтых тел не наблюдается. Но созревание слишком большого количества фолликулов и лютеинизация тех, которые не были забраны для ЭКО, приводит к слишком высокому уровню стероидных гормонов, в частности прогестерона, который автоматически подавляет выработку лютеинизирующего гормона гипофизом. Это, с одной стороны, приводит к преждевременной лютеинизации фолликулов, с другой — подавляет выработку прогестерона.
Тем не менее в 1990-х годах женщинам после ЭКО начали вводить масляные растворы прогестерона вплоть до 16 недель. Это были болезненные инъекции, и они требовали терпеливого хождения женщин в лечебные учреждения для введения гормонов, порой 2 раза в сутки. Таблетированные формы прогестерона оказались совершенно неэффективными.
Когда наступило большее понимание роли прогестерона желтого тела, поддерживающую терапию начали использовать не больше 8 недель, переходя на влагалищные формы введения прогестерона. Комбинация инъекций с влагалищными формами введения прогестерона использовалась очень редко.
Потом гормональная терапия была рекомендована до стабильного роста ХГЧ, что наблюдалось на 5-й неделе беременности, или появления на УЗИ эмбриона с сердцебиением, что можно было увидеть на 6-й неделе.